摘要:1.B 2.C 3.C 4.A 5.C
网址:http://m.1010jiajiao.com/timu_id_233557[举报]
Ⅰ.A、B、C分别代表三种不同的短周期元素.A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍.
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于
(2)当n=2时,B与C形成的晶体属于
Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物.
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是
(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.
查看习题详情和答案>>
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于
σ
σ
键,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是水分子之间存在氢键
水分子之间存在氢键
;(2)当n=2时,B与C形成的晶体属于
分子
分子
晶体.当n=3时,B与C形成的晶体中,B原子的杂化方式为sp3
sp3
,微粒间的作用力是共价键
共价键
;Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物.
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为
C≡O
C≡O
,与CO互为等电子体的离子为CN-
CN-
(填化学式).(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
,Ga的第一电离能却明显低于Zn,原因是Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高
Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高
.(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是
d
d
.a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.
Ⅰ.A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.
已知:B原子有3个能级且各能级电子数相等;D原子最外能层P能级上有2个未成对电子,E是同周期元素中第一电离能最小的元素;F是同周期元素中原子半径最小的元素;A是非金属元素,且A、C、F可形成离子化合物.
请回答:
(1)A、D形成的三原子分子中心原子杂化类型是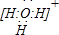
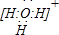 .
.
(2)元素A、D、F形成的原子数之比为1:1:1的化合物的电子式为
 ,其中心原子的杂化类型为
,其中心原子的杂化类型为
(3)请用电子式表示D、E原子个数比为1:1的化合物的形成过程

(4)在B原子与A形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称
Ⅱ.某合金由 X、Y、Z三种元素组成,这三种元素位于周期表中前四周期,X是主要成分元素,X的基态原子中有4个未成对电子.Y的含量不低于11%,否则不能生成致密氧化膜YO3防止腐蚀,Y与X同周期,且原子核外未成对电子数最多.Z位于周期表中第4行、第10列.
(5)请写出X、Y、Z的元素符号及原子序数X
(6)请写出Z的原子核外电子排布式
查看习题详情和答案>>
已知:B原子有3个能级且各能级电子数相等;D原子最外能层P能级上有2个未成对电子,E是同周期元素中第一电离能最小的元素;F是同周期元素中原子半径最小的元素;A是非金属元素,且A、C、F可形成离子化合物.
请回答:
(1)A、D形成的三原子分子中心原子杂化类型是
sp3
sp3
,分子空间构型为三角锥
三角锥
,其电子式为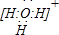
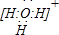
(2)元素A、D、F形成的原子数之比为1:1:1的化合物的电子式为


sp3
sp3
,VSEPR模型空间构型为四面体型
四面体型
.(3)请用电子式表示D、E原子个数比为1:1的化合物的形成过程


(4)在B原子与A形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称
丙烷
丙烷
,A、B、D元素的原子也可以共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式CO2+CO32-+H2O═2HCO3-
CO2+CO32-+H2O═2HCO3-
Ⅱ.某合金由 X、Y、Z三种元素组成,这三种元素位于周期表中前四周期,X是主要成分元素,X的基态原子中有4个未成对电子.Y的含量不低于11%,否则不能生成致密氧化膜YO3防止腐蚀,Y与X同周期,且原子核外未成对电子数最多.Z位于周期表中第4行、第10列.
(5)请写出X、Y、Z的元素符号及原子序数X
Fe、26
Fe、26
、YCr、24
Cr、24
ZNi、28
Ni、28
.(6)请写出Z的原子核外电子排布式
[Ar]3d84s2
[Ar]3d84s2
,X元素在周期表中的位置第四周期第Ⅷ族
第四周期第Ⅷ族
.
Ⅰ.A、B、C分别代表三种不同的短周期元素.A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍.
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于______键,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是______;
(2)当n=2时,B与C形成的晶体属于______晶体.当n=3时,B与C形成的晶体中,B原子的杂化方式为______,微粒间的作用力是______;
Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物.
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为______,与CO互为等电子体的离子为______(填化学式).
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是______,Ga的第一电离能却明显低于Zn,原因是______.
(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是______.
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.
查看习题详情和答案>>
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于______键,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是______;
(2)当n=2时,B与C形成的晶体属于______晶体.当n=3时,B与C形成的晶体中,B原子的杂化方式为______,微粒间的作用力是______;
Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物.
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为______,与CO互为等电子体的离子为______(填化学式).
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是______,Ga的第一电离能却明显低于Zn,原因是______.
(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是______.
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.
查看习题详情和答案>>
A、某研究性学习小组在学习过氧化钠与二氧化碳的反应后,设计实验探究“过氧化钠与二氧化氮是否发生反应”.他们分析过氧化钠和二氧化氮的性质,从理论上分析,过氧化钠和二氧化氮都有氧化性.
①提出假设:
假设Ⅰ:若过氧化钠氧化二氧化氮(反应只生成一种盐),则发生反应:
假设Ⅱ:若二氧化氮氧化过氧化钠(反应生成一种盐和一种气体单质),则发生反应:
②查阅资料:a.亚硝酸钠在酸性条件下能发生自身氧化还原反应:2NaNO2+2HCl═2NaCl+H2O+NO2↑+NO↑;
b.检验NO
的原理:Cu+2NO
+4H+
Cu2++2NO2↑+2H2O.
③设计实验:
a.在一瓶集气瓶里充满红棕色的二氧化氮,用药匙放进一勺淡黄色的过氧化钠粉末,盖上毛玻璃片用力振荡,用手摸瓶壁感觉发烫,红棕色迅速消失了;
b.反应完后,用带火星的木条伸入瓶内,木条不复燃;
c.向反应后的残余物中加入盐酸,无明显现象;
d.将瓶内固体充分溶解,浓缩,再加入浓硫酸和铜粉共热,可产生红棕色有刺激性气味的气体,且溶液呈蓝色.
④实验结论:假设
B、已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验.
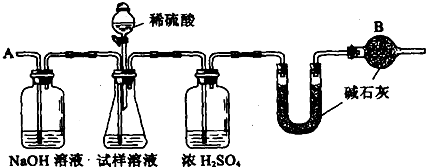
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6mol?L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)装置中干燥管B的作用是
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果
(3)步骤⑤的目的是
(4)步骤⑦的目的是
(5)该试样中纯碱的质量分数的计算式为
×100%
×100%.
查看习题详情和答案>>
①提出假设:
假设Ⅰ:若过氧化钠氧化二氧化氮(反应只生成一种盐),则发生反应:
Na2O2+2NO2═2NaNO3
Na2O2+2NO2═2NaNO3
;假设Ⅱ:若二氧化氮氧化过氧化钠(反应生成一种盐和一种气体单质),则发生反应:
Na2O2+2NO2═2NaNO2+O2
Na2O2+2NO2═2NaNO2+O2
.②查阅资料:a.亚硝酸钠在酸性条件下能发生自身氧化还原反应:2NaNO2+2HCl═2NaCl+H2O+NO2↑+NO↑;
b.检验NO
- 3 |
- 3 |
| ||
③设计实验:
a.在一瓶集气瓶里充满红棕色的二氧化氮,用药匙放进一勺淡黄色的过氧化钠粉末,盖上毛玻璃片用力振荡,用手摸瓶壁感觉发烫,红棕色迅速消失了;
b.反应完后,用带火星的木条伸入瓶内,木条不复燃;
c.向反应后的残余物中加入盐酸,无明显现象;
d.将瓶内固体充分溶解,浓缩,再加入浓硫酸和铜粉共热,可产生红棕色有刺激性气味的气体,且溶液呈蓝色.
④实验结论:假设
假设Ⅰ
假设Ⅰ
(填“Ⅰ”或“Ⅱ”)正确.B、已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验.

主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6mol?L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)装置中干燥管B的作用是
防止空气中的二氧化碳和水蒸气进入U型管中
防止空气中的二氧化碳和水蒸气进入U型管中
;(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果
偏高
偏高
(填高、偏低或不变);(3)步骤⑤的目的是
把反应产生的二氧化碳全部导入U型管中
把反应产生的二氧化碳全部导入U型管中
;(4)步骤⑦的目的是
判断反应产生的二氧化碳是否全部排出,并被U型管中的碱石灰吸收
判断反应产生的二氧化碳是否全部排出,并被U型管中的碱石灰吸收
;(5)该试样中纯碱的质量分数的计算式为
| 106(d-b) |
| 44a |
| 106(d-b) |
| 44a |
A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性.下述为相关实验步骤和实验现象:
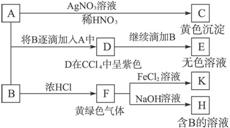
请回答:
(1)写出A、B和C的化学式:A
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
(4)写出由F→H的化学方程式:
查看习题详情和答案>>

请回答:
(1)写出A、B和C的化学式:A
NaI
NaI
,BNaClO
NaClO
,CAgI
AgI
;(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
2I-+ClO-+H2O=I2+Cl-+2OH-
2I-+ClO-+H2O=I2+Cl-+2OH-
,I2+5ClO-+2OH-=2IO3-+5Cl-+H2O
I2+5ClO-+2OH-=2IO3-+5Cl-+H2O
;(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
;(4)写出由F→H的化学方程式:
Cl2+2NaOH=NaClO+NaCl+H2O
Cl2+2NaOH=NaClO+NaCl+H2O
.