题目内容
A、某研究性学习小组在学习过氧化钠与二氧化碳的反应后,设计实验探究“过氧化钠与二氧化氮是否发生反应”.他们分析过氧化钠和二氧化氮的性质,从理论上分析,过氧化钠和二氧化氮都有氧化性.
①提出假设:
假设Ⅰ:若过氧化钠氧化二氧化氮(反应只生成一种盐),则发生反应:
假设Ⅱ:若二氧化氮氧化过氧化钠(反应生成一种盐和一种气体单质),则发生反应:
②查阅资料:a.亚硝酸钠在酸性条件下能发生自身氧化还原反应:2NaNO2+2HCl═2NaCl+H2O+NO2↑+NO↑;
b.检验NO
的原理:Cu+2NO
+4H+
Cu2++2NO2↑+2H2O.
③设计实验:
a.在一瓶集气瓶里充满红棕色的二氧化氮,用药匙放进一勺淡黄色的过氧化钠粉末,盖上毛玻璃片用力振荡,用手摸瓶壁感觉发烫,红棕色迅速消失了;
b.反应完后,用带火星的木条伸入瓶内,木条不复燃;
c.向反应后的残余物中加入盐酸,无明显现象;
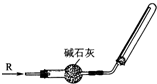
d.将瓶内固体充分溶解,浓缩,再加入浓硫酸和铜粉共热,可产生红棕色有刺激性气味的气体,且溶液呈蓝色.
④实验结论:假设
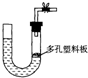
B、已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验.
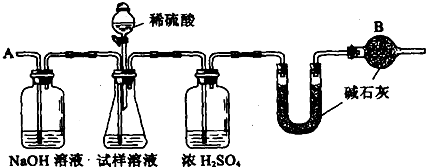
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6mol?L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)装置中干燥管B的作用是
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果
(3)步骤⑤的目的是
(4)步骤⑦的目的是
(5)该试样中纯碱的质量分数的计算式为
×100%
×100%.
①提出假设:
假设Ⅰ:若过氧化钠氧化二氧化氮(反应只生成一种盐),则发生反应:
Na2O2+2NO2═2NaNO3
Na2O2+2NO2═2NaNO3
;假设Ⅱ:若二氧化氮氧化过氧化钠(反应生成一种盐和一种气体单质),则发生反应:
Na2O2+2NO2═2NaNO2+O2
Na2O2+2NO2═2NaNO2+O2
.②查阅资料:a.亚硝酸钠在酸性条件下能发生自身氧化还原反应:2NaNO2+2HCl═2NaCl+H2O+NO2↑+NO↑;
b.检验NO
- 3 |
- 3 |
| ||
③设计实验:
a.在一瓶集气瓶里充满红棕色的二氧化氮,用药匙放进一勺淡黄色的过氧化钠粉末,盖上毛玻璃片用力振荡,用手摸瓶壁感觉发烫,红棕色迅速消失了;
b.反应完后,用带火星的木条伸入瓶内,木条不复燃;
c.向反应后的残余物中加入盐酸,无明显现象;
d.将瓶内固体充分溶解,浓缩,再加入浓硫酸和铜粉共热,可产生红棕色有刺激性气味的气体,且溶液呈蓝色.
④实验结论:假设
假设Ⅰ
假设Ⅰ
(填“Ⅰ”或“Ⅱ”)正确.B、已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验.

主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6mol?L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)装置中干燥管B的作用是
防止空气中的二氧化碳和水蒸气进入U型管中
防止空气中的二氧化碳和水蒸气进入U型管中
;(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果
偏高
偏高
(填高、偏低或不变);(3)步骤⑤的目的是
把反应产生的二氧化碳全部导入U型管中
把反应产生的二氧化碳全部导入U型管中
;(4)步骤⑦的目的是
判断反应产生的二氧化碳是否全部排出,并被U型管中的碱石灰吸收
判断反应产生的二氧化碳是否全部排出,并被U型管中的碱石灰吸收
;(5)该试样中纯碱的质量分数的计算式为
| 106(d-b) |
| 44a |
| 106(d-b) |
| 44a |
分析:A、假设Ⅰ:若过氧化钠氧化二氧化氮反应只生成一种盐,依据氧化还原反应元素化合价变化配平书写发生反应的化学方程式;
假设Ⅱ:二氧化氮氧化过氧化钠反应生成一种盐和一种气体单质,依据氧化还原反应元素化合价变化配平书写发生反应的化学方程式;
根据实验现象可知,反应过程中无氧气生成,说明假设Ⅰ正确;
B、(1)分析实验过程和装置图可知,干燥管是防止空气中的二氧化碳和水蒸气进入U型管中影响测定结果;
(2)硫酸换成盐酸,盐酸溶液中挥发出的氯化氢也会被碱石灰吸收,造成测得结果偏高;
(3)从导管A处缓缓鼓入一定量的空气,目的是把装置中的二氧化碳全部赶入碱石灰被吸收减少误差;
(4)重复步骤⑤和⑥的操作,直到U型管的质量基本不变,是验证二氧化碳是否全部排出,使测定的结构更准确;
(5)依据实验步骤可知U型管的质量变化为增加的二氧化碳气体的质量.称量至恒重为dg,所以二氧化碳气体质量为(d-b)g,依据元素守恒计算得到;
假设Ⅱ:二氧化氮氧化过氧化钠反应生成一种盐和一种气体单质,依据氧化还原反应元素化合价变化配平书写发生反应的化学方程式;
根据实验现象可知,反应过程中无氧气生成,说明假设Ⅰ正确;
B、(1)分析实验过程和装置图可知,干燥管是防止空气中的二氧化碳和水蒸气进入U型管中影响测定结果;
(2)硫酸换成盐酸,盐酸溶液中挥发出的氯化氢也会被碱石灰吸收,造成测得结果偏高;
(3)从导管A处缓缓鼓入一定量的空气,目的是把装置中的二氧化碳全部赶入碱石灰被吸收减少误差;
(4)重复步骤⑤和⑥的操作,直到U型管的质量基本不变,是验证二氧化碳是否全部排出,使测定的结构更准确;
(5)依据实验步骤可知U型管的质量变化为增加的二氧化碳气体的质量.称量至恒重为dg,所以二氧化碳气体质量为(d-b)g,依据元素守恒计算得到;
解答:解:A、假设Ⅰ:若过氧化钠氧化二氧化氮反应只生成一种盐,依据氧化还原反应元素化合价变化配平书写发生反应的化学方程式为:Na2O2+2NO2═2NaNO3;
故答案为:Na2O2+2NO2═2NaNO3;
假设Ⅱ:二氧化氮氧化过氧化钠反应生成一种盐和一种气体单质,依据氧化还原反应元素化合价变化配平书写发生反应的化学方程式为:Na2O2+2NO2═2NaNO2+O2;根据实验现象可知,反应过程中无氧气生成,说明假设Ⅰ正确;
故答案为:Na2O2+2NO2═2NaNO2+O2;假设Ⅰ;
B、(1)分析实验过程和装置图可知,实验是利用碱石灰吸收生成的二氧化碳的质量计算,干燥管是防止空气中的二氧化碳和水蒸气进入U型管中影响测定结果;
故答案为:防止空气中的二氧化碳和水蒸气进入U型管中;
(2)硫酸换成盐酸,盐酸溶液中挥发出的氯化氢也会被碱石灰吸收,造成测得结果偏高;
故答案为:偏高;
(3)从导管A处缓缓鼓入一定量的空气,目的是把装置中的二氧化碳全部赶入碱石灰被吸收减少误差;
故答案为:把反应产生的二氧化碳全部导入U型管中;
(4)重复步骤⑤和⑥的操作,直到U型管的质量基本不变,是验证二氧化碳是否全部排出,使测定的结构更准确;
故答案为:判断反应产生的二氧化碳是否全部排出,并被U型管中的碱石灰吸收;
(5)③称量盛有碱石灰的U型管的质量,得到b g
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g,实验步骤可知U型管的质量变化为增加的二氧化碳气体的质量,称量至恒重为dg,所以二氧化碳气体质量为(d-b)g,依据碳元素守恒计算得到,碳酸钠的质量分数=
×100%=
×100%;
故答案为:
×100%;
故答案为:Na2O2+2NO2═2NaNO3;
假设Ⅱ:二氧化氮氧化过氧化钠反应生成一种盐和一种气体单质,依据氧化还原反应元素化合价变化配平书写发生反应的化学方程式为:Na2O2+2NO2═2NaNO2+O2;根据实验现象可知,反应过程中无氧气生成,说明假设Ⅰ正确;
故答案为:Na2O2+2NO2═2NaNO2+O2;假设Ⅰ;
B、(1)分析实验过程和装置图可知,实验是利用碱石灰吸收生成的二氧化碳的质量计算,干燥管是防止空气中的二氧化碳和水蒸气进入U型管中影响测定结果;
故答案为:防止空气中的二氧化碳和水蒸气进入U型管中;
(2)硫酸换成盐酸,盐酸溶液中挥发出的氯化氢也会被碱石灰吸收,造成测得结果偏高;
故答案为:偏高;
(3)从导管A处缓缓鼓入一定量的空气,目的是把装置中的二氧化碳全部赶入碱石灰被吸收减少误差;
故答案为:把反应产生的二氧化碳全部导入U型管中;
(4)重复步骤⑤和⑥的操作,直到U型管的质量基本不变,是验证二氧化碳是否全部排出,使测定的结构更准确;
故答案为:判断反应产生的二氧化碳是否全部排出,并被U型管中的碱石灰吸收;
(5)③称量盛有碱石灰的U型管的质量,得到b g
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g,实验步骤可知U型管的质量变化为增加的二氧化碳气体的质量,称量至恒重为dg,所以二氧化碳气体质量为(d-b)g,依据碳元素守恒计算得到,碳酸钠的质量分数=
| ||
| ag |
| 106(d-b) |
| 44a |
故答案为:
| 106(d-b) |
| 44a |
点评:本题考查了实验过程分析,物质性质的实验探究和实验测定方法,物质性质和实验操作的目的和实验步骤分析是解题关键,题目难度中等.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目