题目内容
Ⅰ.A、B、C分别代表三种不同的短周期元素.A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍.
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于
(2)当n=2时,B与C形成的晶体属于
Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物.
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是
(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于
σ
σ
键,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是水分子之间存在氢键
水分子之间存在氢键
;(2)当n=2时,B与C形成的晶体属于
分子
分子
晶体.当n=3时,B与C形成的晶体中,B原子的杂化方式为sp3
sp3
,微粒间的作用力是共价键
共价键
;Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物.
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为
C≡O
C≡O
,与CO互为等电子体的离子为CN-
CN-
(填化学式).(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
,Ga的第一电离能却明显低于Zn,原因是Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高
Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高
.(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是
d
d
.a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.
分析:Ⅰ、A、B、C分别代表三种不同的短周期元素.C原子的最外层电子数是其电子层数的3倍,则C原子有2个电子层,最外层电子数为6,故C为氧元素;
(1)若A原子的最外层电子排布为1s1,则A为氢元素,与氧元素采取s-p重叠发生成键;由于水分子之间存在氢键,沸点高于同主族其它元素氢化物;
(2)当n=2时,则B为碳元素,与氧元素形成的CO、二氧化碳都属于分子晶体;
当n=3时,则B为Si元素,与氧元素组成SiO2,二氧化硅属于原子晶体,Si原子以氧原子之间形成4个Si-O键,Si采取sp3杂化,微粒间作用力为共价键;
Ⅱ、(3)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键;
原子数目相同,电子总数(价电子总数)相同的微粒属于等电子体,据此书写;
(4)镓是31号元素,根据核外电子排布规律书写其基态原子的电子排布式;
Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,第一电离能较高;
(5)计算中心原子的价层电子对数与孤电子对数,据此判断.
(1)若A原子的最外层电子排布为1s1,则A为氢元素,与氧元素采取s-p重叠发生成键;由于水分子之间存在氢键,沸点高于同主族其它元素氢化物;
(2)当n=2时,则B为碳元素,与氧元素形成的CO、二氧化碳都属于分子晶体;
当n=3时,则B为Si元素,与氧元素组成SiO2,二氧化硅属于原子晶体,Si原子以氧原子之间形成4个Si-O键,Si采取sp3杂化,微粒间作用力为共价键;
Ⅱ、(3)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键;
原子数目相同,电子总数(价电子总数)相同的微粒属于等电子体,据此书写;
(4)镓是31号元素,根据核外电子排布规律书写其基态原子的电子排布式;
Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,第一电离能较高;
(5)计算中心原子的价层电子对数与孤电子对数,据此判断.
解答:解:Ⅰ、A、B、C分别代表三种不同的短周期元素.C原子的最外层电子数是其电子层数的3倍,则C原子有2个电子层,最外层电子数为6,故C为氧元素;
(1)若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键,属于σ键;
由于水分子之间存在氢键,沸点高于同主族其它元素氢化物,
故答案为:σ;水分子之间存在氢键;
(2)当n=2时,则B为碳元素,与氧元素形成的CO、二氧化碳都属于分子晶体;
当n=3时,则B为Si元素,与氧元素组成SiO2,二氧化硅属于原子晶体,Si原子以氧原子之间形成4个Si-O键,Si采取sp3杂化,微粒间作用力为共价键;
故答案为:sp3;共价键;
Ⅱ3)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键,结构式为C≡O;
与CO互为等电子体的离子为CN-,
故答案为:C≡O;CN-;
(4)镓是31号元素,其基态原子的电子排布式为1s22s22p63s23p63d104s24p1,;
Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高;
故答案为:1s22s22p63s23p63d104s24p1;Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高;
(5)H2Se中心原子Se价层电子对数=2+
=4,孤电子对数为2,为V形;BBr3中心原子B原子的价层电子对数=3,不含孤对电子,为平面正三角形,
故答案为:d.
(1)若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键,属于σ键;
由于水分子之间存在氢键,沸点高于同主族其它元素氢化物,
故答案为:σ;水分子之间存在氢键;
(2)当n=2时,则B为碳元素,与氧元素形成的CO、二氧化碳都属于分子晶体;
当n=3时,则B为Si元素,与氧元素组成SiO2,二氧化硅属于原子晶体,Si原子以氧原子之间形成4个Si-O键,Si采取sp3杂化,微粒间作用力为共价键;
故答案为:sp3;共价键;
Ⅱ3)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键,结构式为C≡O;
与CO互为等电子体的离子为CN-,
故答案为:C≡O;CN-;
(4)镓是31号元素,其基态原子的电子排布式为1s22s22p63s23p63d104s24p1,;
Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高;
故答案为:1s22s22p63s23p63d104s24p1;Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高;
(5)H2Se中心原子Se价层电子对数=2+
| 6-1×2 |
| 2 |
故答案为:d.
点评:本题是物质结构的综合题目,涉及核外电子排布规律、化学键、晶体类型、分子构型、杂化理论、价层电子对互斥理论、元素周期律等,题目综合性较大,需要学生对基础知识全面掌握,难度中等.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
 (2011?江山市模拟)第28届夏季奥运会在北京成功举办,向世界人民展示了中国人的风采和北京的魅力.奥运五环象征着五大洲的团结以及全世界运动员以公正、坦率的比赛和友好的精神.“北京欢迎您”不仅是北京奥运会的主题歌也是吉祥物的“名字”也正好是五个环相一致(如图所示).
(2011?江山市模拟)第28届夏季奥运会在北京成功举办,向世界人民展示了中国人的风采和北京的魅力.奥运五环象征着五大洲的团结以及全世界运动员以公正、坦率的比赛和友好的精神.“北京欢迎您”不仅是北京奥运会的主题歌也是吉祥物的“名字”也正好是五个环相一致(如图所示).


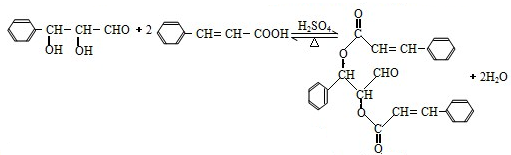
 或
或
 ,现有A、B、C、D、E、F、G、H八种有机物,存在如下图所示的转化关系:
,现有A、B、C、D、E、F、G、H八种有机物,存在如下图所示的转化关系:


 可简写为
可简写为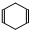 .现有某化合物W的分子结构可表示为:
.现有某化合物W的分子结构可表示为: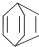 .
.