题目内容
 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ/mol
则32g肼完全燃烧得到气态产物时放出热量
534
534
kJ.(2)肼--空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,正极的电极反应式是
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
,电池工作一段时间后,电解质溶液的pH将减小
减小
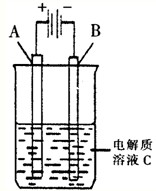
(填“增大”、“减小”、“不变”).(3)如图是一个电化学装置示意图.用肼--空气燃料电池做此装置的电源.
①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4.该装置的实际意义是
精炼粗铜
精炼粗铜
.②如果A是铂电极,B是石墨电极,C是AgNO3溶液,电解的离子方程式为
4AgNO3+2H2O
4Ag+4HNO3+O2↑
| ||
4AgNO3+2H2O
4Ag+4HNO3+O2↑
,若
| ||
B
B
极(填A或B)增重10.8g,该燃料电池理论上消耗0.025mol
0.025mol
molN2H4.分析:(1)由盖斯定律可得肼完全燃烧得到气态产物的热化学方程式,结合肼的物质的量计算反应热;
(2)肼--空气燃料电池是一种碱性燃料电池工作时,正极发生还原反应,根据原电池总反应式可判断溶液pH的变化;
(3)①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4,应为铜的精炼装置;
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,在阴极上析出Ag,阳极上OH-被氧化生成O2,根据电极反应式计算.
(2)肼--空气燃料电池是一种碱性燃料电池工作时,正极发生还原反应,根据原电池总反应式可判断溶液pH的变化;
(3)①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4,应为铜的精炼装置;
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,在阴极上析出Ag,阳极上OH-被氧化生成O2,根据电极反应式计算.
解答:解:(1)已知①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol,
②2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ/mol,
利用盖斯定律将
可得:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol,
n(N2H4)=
=1mol,
则32g肼完全燃烧得到气态产物时放出热量为1mol×534kJ/mol=534kJ,
故答案为:534;
(2)肼--空气燃料电池是一种碱性燃料电池工作时,正极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,负极反应式为N2H4-4e-+4OH-=N2+4H2O,电池总反应式为N2H4+O2=N2+2H2O,由总反应式可知,反应生成水,OH-浓度减小,则pH减小,
故答案为:O2+2H2O+4e-=4OH-;减小;
(3)①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4,则电解池工作时,阴极生成铜,阳极消耗粗铜,应为铜的精炼装置,
故答案为:精炼粗铜;
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,在阴极上析出Ag,电极反应式为Ag++e-=Ag,
阳极上OH-被氧化生成O2,电极反应式为4OH-=O2+2H2O+4e-,总反应式为4AgNO3+2H2O
4Ag+4HNO3+O2↑,
n(Ag)=
=0.1mol,得到0.1mol电子,由N2H4-4e-+4OH-=N2+4H2O可知,需要n(N2H4)=
=0.025mol,
故答案为:4AgNO3+2H2O
4Ag+4HNO3+O2↑;B;0.025mol.
②2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ/mol,
利用盖斯定律将
| ①+② |
| 2 |
n(N2H4)=
| 32g |
| 32g/mol |
则32g肼完全燃烧得到气态产物时放出热量为1mol×534kJ/mol=534kJ,
故答案为:534;
(2)肼--空气燃料电池是一种碱性燃料电池工作时,正极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,负极反应式为N2H4-4e-+4OH-=N2+4H2O,电池总反应式为N2H4+O2=N2+2H2O,由总反应式可知,反应生成水,OH-浓度减小,则pH减小,
故答案为:O2+2H2O+4e-=4OH-;减小;
(3)①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4,则电解池工作时,阴极生成铜,阳极消耗粗铜,应为铜的精炼装置,
故答案为:精炼粗铜;
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,在阴极上析出Ag,电极反应式为Ag++e-=Ag,
阳极上OH-被氧化生成O2,电极反应式为4OH-=O2+2H2O+4e-,总反应式为4AgNO3+2H2O
| ||
n(Ag)=
| 10.8g |
| 108g/mol |
| 0.1mol |
| 4 |
故答案为:4AgNO3+2H2O
| ||
点评:本题考查电化学知识,题目难度中等,本题注意电极反应式的书写,为解答本题的关键,也是易错点.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料. 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题:
 肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料. 肼(N2H4)又称联氨,可用作火箭燃料.肼一空气燃料电池中的电解质溶液是20%~30%的KOH溶液.该燃料电池可作为如图装置中的电源.下列判断错误的是( )
肼(N2H4)又称联氨,可用作火箭燃料.肼一空气燃料电池中的电解质溶液是20%~30%的KOH溶液.该燃料电池可作为如图装置中的电源.下列判断错误的是( )