1、固体的溶解度
(1)溶解度的定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量
四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:溶解度的单位:克
(2)溶解度的含义:
20℃时NaCl的溶液度为36g含义:
在20℃时,在100克水中最多能溶解36克NaCl
或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克
(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类) ②温度
 大多数固体物的溶解度随温度升高而升高;如KNO3
大多数固体物的溶解度随温度升高而升高;如KNO3
少数固体物质的溶解度受温度的影响很小;如NaCl
极少数物质溶解度随温度升高而降低。如Ca(OH)2
(4)溶解度曲线
|
|
|
|
|
|
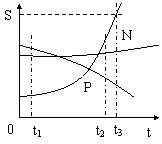
(4)t1℃时A、B、C、溶解度由大到小的顺序C>B>A
(5)从A溶液中获取A晶体可用降温结晶 的方法获取晶体。
(6)从B的溶液中获取晶体,适宜采用 蒸发结晶 的方法获取晶体
(7)t2℃ 时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有A和B 无晶体析出的有 C ,所得溶液中溶质的质量分数由小到大依次为 A<C<B
(8)除去A中的泥沙用 过滤 法;分离A与B(含量少)的混合物,用 结晶 法
|
|
分子 |
原子 |
|
定义 |
分子是保持物质化学性质最小的微粒 |
原子是化学变化中的最小微粒。 |
|
性质 |
体积小、质量小;不断运动;有间隙 |
|
|
联系 |
分子是由原子构成的。分子、原子都是构成物质的微粒。 |
|
|
区别 |
化学变化中,分子可分,原子不可分。 |
化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
 公式:
公式: 结晶的两种方法 蒸发溶剂,如NaCl(海水晒盐)
结晶的两种方法 蒸发溶剂,如NaCl(海水晒盐) (3)饱和溶液和不饱和溶液之间的转化
(3)饱和溶液和不饱和溶液之间的转化 组成:物质(纯净物)由元素组成
组成:物质(纯净物)由元素组成 原子:金属、稀有气体、碳、硅等。
原子:金属、稀有气体、碳、硅等。 混合物(多种物质)
混合物(多种物质) 分类 单质 :金属、非金属、稀有气体
分类 单质 :金属、非金属、稀有气体 (一种物质) 化合物: 有机化合物 CH4、C2H5OH、C6H12O6、淀粉、蛋白质
(一种物质) 化合物: 有机化合物 CH4、C2H5OH、C6H12O6、淀粉、蛋白质 (多种元素)
氧化物
H2O CuO CO2
(多种元素)
氧化物
H2O CuO CO2