4. 将甲和乙气体同时通入过量丙溶液中,充分反应后一定产生沉淀的组合是
|
序号 |
甲 |
乙 |
丙 |
|
① |
CO2 |
SO2 |
Ca(OH)2 |
|
② |
HCl |
CO2 |
Ca(OH)2 |
|
③ |
CO2 |
SO2 |
Ba(NO3)2 |
|
④ |
NO2 |
SO2 |
BaCl2 |
|
⑤ |
CO2 |
NH3 |
CaCl2 |
|
⑥ |
O2 |
NH3 |
AlCl3 |
A.①②⑤ B.①③④⑤⑥ C.①②③④⑥ D.全部
14.下列离子方程式书写正确的是
A.溴乙烷与6mol/L的氢氧化钠水溶液共热:
C2H5Br+OH- CH2=CH2↑+Br-+H2O
CH2=CH2↑+Br-+H2O
B.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合:
Ca2++2HCO3-+2OH- CaCO3↓+CO32-+2H2O
CaCO3↓+CO32-+2H2O
C.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入1~2滴盐酸:
3Fe2++4H++NO3- 3Fe3++NO↑+2H2O
3Fe3++NO↑+2H2O
D.在H2O2中加入酸性高锰酸钾溶液:
2MnO4-+6H++5H2O2 2Mn2++5O2↑+8H2O
2Mn2++5O2↑+8H2O
15:人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2  O2+HbCO,
37 ℃时,该反应的平衡常数K=220.HbCO的浓度达到HbO2溶液的0.02倍,导致人智力受损。据此,下列结论错误的是
O2+HbCO,
37 ℃时,该反应的平衡常数K=220.HbCO的浓度达到HbO2溶液的0.02倍,导致人智力受损。据此,下列结论错误的是
A.CO与HbO2反应的平衡常数K=
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
16:控制适合的条件,将反应2Fe3++2I-  2Fe2++I1设计成如右图所示的原电池。下列判断不正确的是
2Fe2++I1设计成如右图所示的原电池。下列判断不正确的是
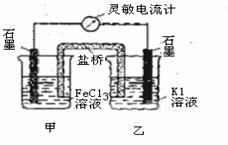 A.反应开始时,乙中石墨电极上发生氧化反应
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,
乙中石墨电极为负极
17 完全溶解28.4 g 的碳酸铜和氢氧化铜的混合物,需要消耗1 mol·L-1的盐酸500 mL,若灼烧相同质量的上述混合物,得到氧化铜的质量为
A.40 g B.30 g C.20 g D.16 g
18:将一定体积稀硝酸溶液平均分为两份,一份与足量的铜粉反应收集到气体体积为V1;另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到气体的体积为V2(V1和V2都在同一条件下测定),已知V2=3V1,则稀硝酸和稀硫酸的物质的量浓度之比1
A.1︰1 B.1︰2 C.1︰3 D.无法确定
选择题答案请填入下表
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
|
|
|
|
|
|
|
|
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
|
|
|
|
|
|
|
|
|
19:七种元素A、B、C、D、E、F,G,它们的原子序数依次增大:其中A、B、C、D、E、F为短周期元素,B与A能以1:1、1:2或l:3等形成多种常见化合物;C原子的p轨道中有3个电子;D与F元素位于同一主族:D与E能以1:1或1:2形成两种常见化合物。G的原子序数为29
(1)A与B能形成一种最简单的直线型分子,其结构式是____________________________
(2)A、D、F元素中形成的两种双核阴离子,在溶液中反应方程式为
__________________________________________________________________________
(3)E与F形成的化合物的电子式为_________ _,用惰性电极电解该化合物的水溶液时,有固体析出反应方程式为___________________________________。
(4)C、D、F元素的第一电离能由大到小的顺序是______________。
(5)G元素在周期表的位置为 ,其原子的电子排布式为 。(6) G长时间放置在潮湿的空气中易发生电化学腐蚀生成锈迹,该腐蚀的正极反应式为 ;
写出生成该锈迹的化学反应方程式
20:下图中A~N分别代表化学反应中的一种常见物质。A是一种常见化肥,B在工业上可由G和空气中含量最多的气体制得。常温下,C是液体。E、N、H为金属单质,G、I、M为非金属单质,其中G、M是气体。K是天然气的主要成分,F是具有磁性的黑色晶体。个别反应产物及条件略去。
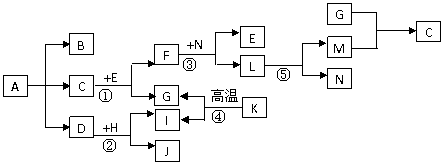
(1)F的化学式为__________;K分子的空间结构是__________。
(2)反应⑤的条件是____________________。
(3)实验室制取B的化学方程式是_________ 。
(4)反应②中,将点燃的H放入盛有D的集气瓶里,可观察到的现象是:______________ _
(5)写化学方程式:反应①________________________________________________;
反应③________________________________________________。
(6)将F放入稀盐酸中,可生成两种不同价态的金属阳离子。要检验其中的高价态金属阳离子,应加入的试剂是_______________________。
21:铜是人类最早使用的金属之一,铜的矿物主要有辉铜矿(Cu2S)、黄铜矿(CuFeS2)、赤铜矿(Cu20)等。铜及其化合物一般都有颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H20呈蓝色等。已知:①CuO经高温灼烧生成Cu20;②Cu2O属于碱性氧化物;③Cu2O+2H+====Cu+Cu2++H2O。
(1) 工业冶炼铜的主要原料是黄铜矿,其生产过程开始的两步是:
①富集:将矿物进行浮选;
②焙烧:把得到的精矿用空气进行焙烧,将其中的铁元素转变为硫化亚铁、铜元素转变为硫化亚铜,试写出焙烧反应的化学方程式并配平: 。
(2)其后续生产过程如,
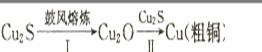
当用于步骤I Cu2S的量是用于步骤Ⅱ的 倍时,恰好能使Cu2S全部转化为铜。
(3) 将经高温灼烧后的CuO样品投入足量的热的稀硝酸溶液中,下列有关说法中正确的是
A.如果溶液呈蓝色,说明样品没有分解
B.如果溶液变为蓝色、同时有紫红色固体出现,说明样品全部生成了Cu2O
C.溶液中最终不可能有紫红色固体出现
D.这种实验的结果无法说明CuO分解的程度
E.如果溶液中出现蓝色,最终没有紫红色固体出现,说明CuO完全分解了
(4) 黄铜矿冶炼铜产生的炉渣中含有Fe2O3、FeO、SiO2、A12O3等物质。选用提供的试剂,设计一个实验,以验证炉渣中含有FeO,应选择的试剂为 。
A.稀盐酸 B.稀硫酸 C .KSCN溶液
D. KMnO4溶液 E.NaOH溶液
证明炉渣中含有FeO的实验操作(简述)
现象为 。
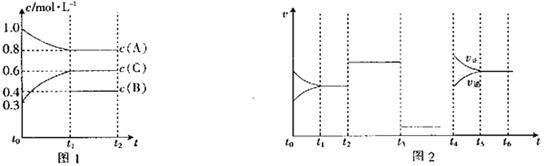 22:向一体积不变的密闭容器中充入
22:向一体积不变的密闭容器中充入 和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图l所示,其中
和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图l所示,其中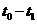 阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且
阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且 各改变一种不同的条件。
各改变一种不同的条件。
(1)若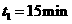 ,则
,则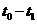 阶段以C的浓度变化表示的反应速率
阶段以C的浓度变化表示的反应速率 。
。
(2)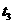 时改变的条件为
,B的起始物质的量为
。
时改变的条件为
,B的起始物质的量为
。
(3)各阶段平衡时对应的平衡常数如下表所示:
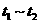
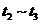
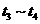

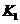

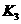
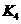
则 (保留两位小数),K1、K2、K3、K4之间的关系为
。
(保留两位小数),K1、K2、K3、K4之间的关系为
。
(用“>”、“<”或“=”连接)。
(4)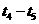 阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为
阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为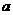 kJ,写出此条件下该反应的热化学方程式:
。
kJ,写出此条件下该反应的热化学方程式:
。
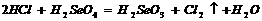 ,
, 如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是 右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O  H2↑+C12↑+2OH- (2)NaOH NaClO
H2↑+C12↑+2OH- (2)NaOH NaClO ]2-Na+
]2-Na+ 5C1一 N2↑ 1
5C1一 N2↑ 1