(三)硅酸盐工业简介
|
|
水泥 |
玻璃(普通) |
|
原料 |
石灰石、粘土 |
纯碱、石灰石、石英 |
|
设备 |
迴转窑 |
 玻璃熔炉 玻璃熔炉 |
|
反应 |
复杂的物理化学变化 |
 Na2CO3+SiO2 Na2SiO3+CO2↑ Na2CO3+SiO2 Na2SiO3+CO2↑CaCO3+SiO2 CaSiO3+CO2↑ |
|
主要成分 |
3CaO·SiO2 2CaO· SiO2 3CaO·Al2O3 |
Na2O·CaO· 6SiO2 |
|
特性 |
水硬性 (加石膏调节硬化速度) |
玻璃态物质 (在一定温度范围内软化) 非晶体 |
陶瓷:
(1)主要原料:粘土
(2)生产过程:混合→成型→干燥→烧结→冷却→陶器
(3)陶与瓷的制取区别: ①原料粘土的纯度不同
②烧制温度不同。
(二)典型构质的性质
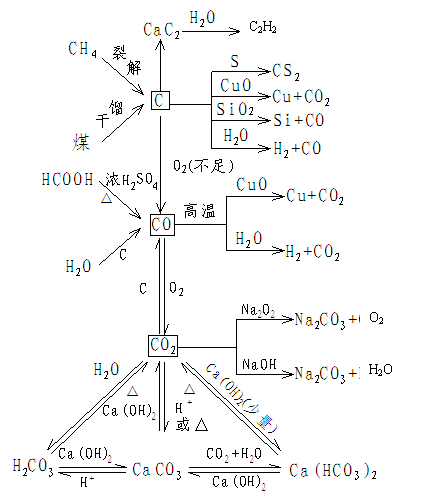
1.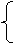 单质碳
C原子间结合方式
单质碳
C原子间结合方式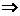
(1)同素异形体的多样性
分子中所含C原子数不同
金刚石--原子晶体
 原子晶体
原子晶体
石墨--混合晶体
分子晶体
(2)活性炭的重要性质和作用
↓
多孔疏松结构→吸附力强→吸附气体或溶液里的某些有色物质。
↓实例
①去臭气--吸附水中有臭味物质(净化水)
②漂白--吸附某些食物和工业产品中的色素
③去毒--吸附有毒气体(如NO2、Cl2等)(用于防毒面具)
(3)碳的化学性质
常温:稳定
加热、高温或点燃:常表现还原性,作还原剂
一般加热时,C → CO2
 高温时,C → CO
高温时,C → CO
 如: C+H2O CO+H2
如: C+H2O CO+H2

 2C+SiO2 2CO+Si
2C+SiO2 2CO+Si
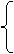 C+2CuO 2Cu + CO2
C+2CuO 2Cu + CO2
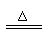
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
想一想:为什么木炭燃烧时无火焰?
2.碳的氧化物
CO、CO2尽管用为碳的氧化物,但是两者的物理性质,化学性质均有较大区别,可列表比较如下:
|
|
CO |
CO2 |
|
物理性质 |
无色无气味气体难溶于水 |
无色略带酸味气体能溶于水(1 :1) |
|
毒性 |
有毒(与血红蛋白结合) |
无毒(大量排放会导致温室效应) |
|
化学性质 |
①可燃性 ②还原性 ③不与碱液反应 |
①一般不可燃烧,也不支持燃烧但Mg、Li能在CO2中燃烧 ②弱氧化性 ②弱氧化性 2Mg+CO2 C+2MgO 2Mg+CO2 C+2MgOC+CO2 2CO ③与碱液反应 |
|
类别 |
不成盐氧化物 |
酸性氧化物 |
|
检验 |
点燃后在火焰 上方罩上干燥的 烧杯和用清石  灰水润洗过的烧杯 灰水润洗过的烧杯 |
能使清石灰水变浊但不能使品红褪色(有别于SO2) |
|
实验室制法 |
HCOOH
CO↑+H2O |
CaCO3+2HCl==CaCl2+CO2↑+H2O |
|
工业制法 |
 水煤气法: 水煤气法:C+H2O CO+H2 |
 煅烧石灰石法: 煅烧石灰石法:CaCO3 CaO+CO2↑ |
思考下列小问题:
①如何除去CO中少量CO2?
②如何除去CO2中少量CO?
③如何分离CO和CO2?
3.比较CO2和SiO2
CO2和SiO2是同主族元素形成的高价氧化物。化学性质有一定的相似性,但物理性质和某些化学性质方面却有很大差异。
|
|
CO2
SiO2 |
|||
|
与碱性氧化物反应 |
酸 性 氧 化 性 |
|||
|
CaO+CO2=CaCO3 |
 CaO+SiO2 CaSiO3 |
|||
|
与碱液反应 |
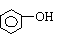 2NaOH+CO2=Na2CO3+H2O 2NaOH+CO2=Na2CO3+H2O |
SiO2+2NaOH
= Na2SiO3+H2O |
||
|
与盐反应 |
C6H5Ona+CO2+H2O→
+NaHO3 Na2SiO3+CO2+H2O=Na2CO3 +H2SiO3↓ NaAlO2+CO2+2H2O=Al(OH)3↓ +NaHCO3 |
  2Na2CO3+SiO2 Na2SiO3+CO2↑ 2Na2CO3+SiO2 Na2SiO3+CO2↑CaCO3+SiO2 CaSiO3+CO2↑ (难挥发酸酐→易挥发酸酐) |
||
|
与碳反应 |
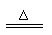 C+CO2 2CO |
 2C+SiO2 Si+2CO |
||
|
与H2O作用 |
 CO2+H2O H2CO3 CO2+H2O H2CO3 |
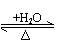
SiO2 H2SiO3 -H2O |
||
|
与酸反应 |
不反应 |
只与HF反应 SiO2+4HF=SiF4↑+H2O |
||
|
晶体类型 |
分子晶体 |
原子晶体 |
||
|
熔点 |
低(易升华) |
高 |
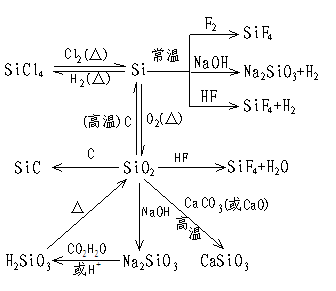
4.Si的非寻常性
(1)硅不活泼、但自然界无游离态,通常以硅酸盐形式存在
(2)硅不与一般的强酸、强氧化性酸反应,但常温却下HF反应,且能置换出其中的H。
Si+4HF==SiF4+2H2↑
(3)碳不与碱液反应,但硅常温即可与碱液反应并放出H2,表现出与Al有相似性。
Si+2NaOH+2H2O==Na2SiO3+2H2↑
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
其它固体非金属即使与碱液反应,一般也无H2产生。如
3S+6NaOH==2Na2S+Na2SO3+3H2O
5.碳酸正盐和酸式盐
(1)溶解性:
①大多正盐难溶于水(除K+、Na+、NH4+)
而一般酸式碳酸盐均可溶于水
②同一种阳离子的盐
一般:酸式盐>正盐
如 Ca(HCO3)2>CaCO3
KHCO3>K2CO3
但 NaHCO3<Na2CO3
想一想:为什么在饱和Na2CO3溶液中通入足量的CO2有晶体析出?
提示:Na2CO3+CO2+H2O==2NaHCO3
106g 18g 168g
①溶剂水量减少
②生成NaHCO3质量比消耗的Na2CO3质量大
③同温下溶解性 NaHCO3<Na2CO3
(2)与酸反应的过程及速度(同条件)
H++CO32-==HCO3-
HCO3-+H+==H2O+CO2↑
放出气体速度:HCO3->CO32-
(3)与碱液反应
 Na2CO3+NaOH→不反应
Na2CO3+NaOH→不反应
NaHCO3+NaOH==Na2CO3+H2O
 Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
2NaHCO3+Ca(OH)2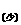 ==CaCO3↓+Na2CO3+H2O
==CaCO3↓+Na2CO3+H2O
(4)热稳定性:
正盐>相应酸式盐

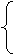 如: CaCO3 CaO+CO2↑
如: CaCO3 CaO+CO2↑
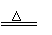
Ca(HCO3)2 CaCO3↓+H2O+CO2↑
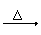
 Na2CO3 不分解
Na2CO3 不分解
2NaHCO3 Na2CO3+CO2↑+H2O
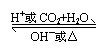 (5)相互转化:
(5)相互转化:
正盐(CO32-) 酸式盐(HCO3-)
 的溴离子被氧化成溴单质。求原溴化亚铁溶液的物质的量浓度。
的溴离子被氧化成溴单质。求原溴化亚铁溶液的物质的量浓度。