26、(12分)有下列七种溶液:A、氢氧化钠溶液;B、氢氧化钡溶液;C、硫酸铝溶液;D、明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化铁溶液;任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀。试回答下列问题:
⑴产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
|
组别 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
甲 |
B |
|
|
|
|
|
|
|
|
乙 |
D |
|
|
|
|
|
|
|
 ⑵请在下列坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液体积(VB/L)变化的曲线。
⑵请在下列坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液体积(VB/L)变化的曲线。
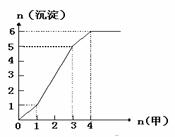 ⑶右图是某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合是:甲 (填化学式)、乙 (填化学式)。
⑶右图是某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合是:甲 (填化学式)、乙 (填化学式)。
① 若实验时取用的乙溶液为500 mL,试计算乙溶液中溶质的物质的量的浓度。
②若向500 mL乙溶液中滴加1 000 mL甲溶液时恰好得到bmol(1<b<5)白色沉淀,请计算甲溶液中溶质的物质的量浓度。
第Ⅱ卷(非选择题 共76分)答题卷 姓名 得分
25、(8分)将固体FeC2O4·2H2O放在一个可以称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下:
|
温度℃ |
25 |
300 |
350 |
400 |
500 |
600 |
900 |
|
固体质量 |
1.000 |
0.800 |
0.800 |
0.400 |
0.444 |
0.444 |
0.430 |
根据计算分析推理,完成下列填空:
(1)写出25~300℃时固体发生变化的反应方程式______________________
判断的理由是___________________________________________________
(2)350~400℃发生变化得到的产物是____________________________
物质的量之比是_________________________
(3)500℃时产物的含氧质量分数为____________________________
(4)写出600~900℃时发生变化的化学方程式_______________________
20、(本题共12分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
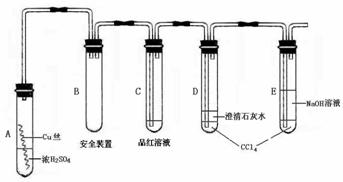
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。

|
根据上述材料回答下列问题
(1)A试管上方的长导管的作用是__________;D、E两支试管中CCl4的作用是__________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:____。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:____。设计实验验证你的猜想______。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是____。(写化学式)
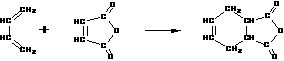
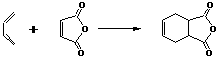
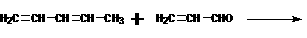
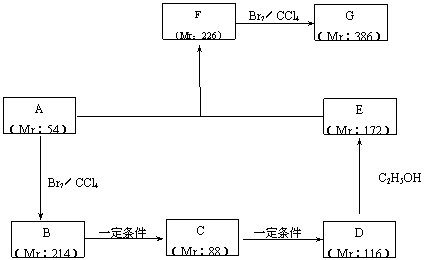 (2)以某链烃A为起始原料合成化合物X的路径如下(图中Mr表示相对分子质量):
(2)以某链烃A为起始原料合成化合物X的路径如下(图中Mr表示相对分子质量):
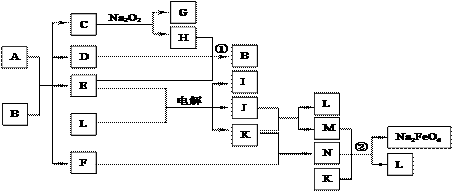 请填写以下空白:
请填写以下空白: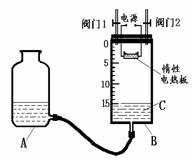 (2)某同学设计了如图所示测定红磷在氯气中燃烧产物的分子式的装置,该装置中B是底面积为100
cm2的圆筒状玻璃容器(密封盖上装有阀门),上面标有厘米单位的刻度,其它夹持装置已略去。
(2)某同学设计了如图所示测定红磷在氯气中燃烧产物的分子式的装置,该装置中B是底面积为100
cm2的圆筒状玻璃容器(密封盖上装有阀门),上面标有厘米单位的刻度,其它夹持装置已略去。