23.(10分)已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示:
|
|
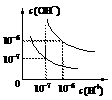
(1)则25 ℃时水的电离平衡曲线应为_____(填“A”或“B”)请说明理由
。
(2)25 ℃时,将pH = 9的NaOH溶液与pH = 4的H2SO4溶液混合,若所得混合溶液的pH = 7,则NaOH溶液与H2SO4溶液的体积比为_______________。
(3)95 ℃时,若100体积pH1 = a的某强酸溶液与1体积pH2 = b的某强碱溶液混合后溶液呈中性,则混合前,pH1与pH2之间应满足的关系是______________________。
(4)曲线B对应温度下,pH = 2的某HA溶液和pH = 10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因:
湖南省汝城二中2010年下期高二第二次月考化学试卷
15.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
 将正确答案填入下列表中
将正确答案填入下列表中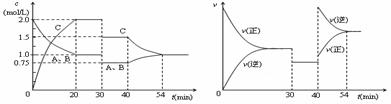
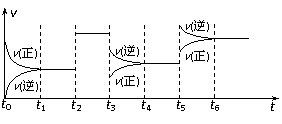 A.t2时加入了正催化剂
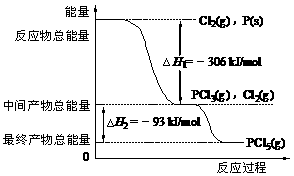
A.t2时加入了正催化剂 H+ + OH-;ΔH>0 ,下列叙述正确的是( )
H+ + OH-;ΔH>0 ,下列叙述正确的是( )