18、(18分)全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%。
 ⑴
地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
。
⑴
地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
。
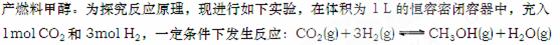 ⑵ 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生△H=-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
⑵ 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生△H=-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
① 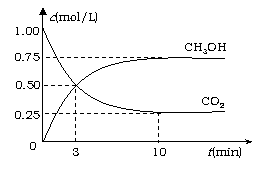 从反应开始到平衡,氢气的平均反应速率
从反应开始到平衡,氢气的平均反应速率
v(H2)=___________mol/(L·min);
② 氢气的转化率= ;
③ 该反应的平衡常数为 (保留小数点后2位);
④ 下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑤ 当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2。则c1 c2的关系(填>、<、=)。
 ⑶ 减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标。如图所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。将其插入KOH溶液从而达到吸收CO2的目的。请回答:
⑶ 减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标。如图所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。将其插入KOH溶液从而达到吸收CO2的目的。请回答:
① 通入甲烷一极的电极反应式为 ;
② 随着电池不断放电,电解质溶液的pH (填“增大”、“减小”或“不变”)。
③ 通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
2009-2010学年度第一学期高二年级期末模块检测
化 学 试 题 答 卷 纸
|
|

14、在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
|
序号 |
锌的质量/g |
锌的形状 |
温度/℃ |
完全溶解于酸的时间/s |
|
A |
2 |
薄片 |
5 |
400 |
|
B |
2 |
薄片 |
15 |
200 |
|
C |
2 |
薄片 |
25 |
100 |
|
D |
2 |
薄片 |
30 |
t1 |
|
E |
2 |
薄片 |
35 |
50 |
|
F |
2 |
颗粒 |
15 |
t2 |
|
G |
2 |
粉末 |
15 |
t3 |
则下列说法正确的是:
① t1=75s ② t2>200>t3 ③ 单位时间内消耗的锌的质量mG>mF>mB
A. ① B. ①② C. 只有② D. 全部正确
第Ⅱ卷(共计58分)
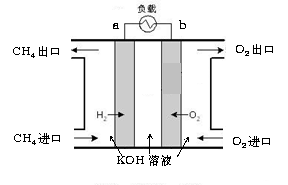
 ① 从实验装置上看,图中尚缺少的一种玻璃仪器是
;
① 从实验装置上看,图中尚缺少的一种玻璃仪器是
;
② 大小烧杯之间填满纸屑的作用是 ;
③ 向组装好的量热器中加入50mL盐酸并测定温度,取出温度计并冲
净后,再将已测定好温度的NaOH溶液50mL加入量热器。下列加入50mL NaOH溶液的操作正确的是 。
A. 为了使酸碱充分中和,必须边滴加NaOH溶液边迅速搅拌
B. 把50mL NaOH溶液一次迅速倒入,盖上纸板迅速搅拌。
④ 若用醋酸代替上述盐酸实验,实验测得的中和热值 (填偏 大、偏小或无影响)。
大、偏小或无影响)。
⑵、用实验室准确配制的0.100mol/L的N aOH溶液测定某未知浓度的稀盐酸。
aOH溶液测定某未知浓度的稀盐酸。
 其具体实验步骤如下:
其具体实验步骤如下:
(填写颜色变化)且半分钟内不褪色时,即达到滴定终 点;
点;
④ 记录液面刻度读数。根据滴定管的两次读数得出消耗标准盐酸的体积,再 重复测定两次,实验结果记录见下表:
重复测定两次,实验结果记录见下表:
|
实验次数 |
起始滴定管读数 |
终点滴定管读数 |
|
1 |
0.00mL |
24.02mL |
|
2 |
0.50mL |
24.46mL |
|
3 |
1.00mL |
25.02mL |
测得未知稀盐酸的物质的量浓度为 (保留小数点后3位)。
⑤ 如果滴定结束时俯视碱式滴定管刻度读数(其它操作均正确),则对滴定结果-稀盐酸浓度的影响是 (填“偏高”、“偏低”或“无影响”)。
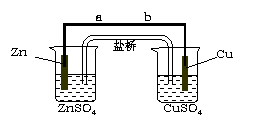
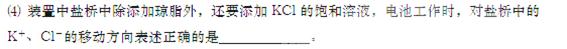
 C. 盐桥中的K+、Cl-都向右侧烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动 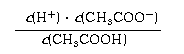
 ⑷ 对于醋酸溶液和醋酸钠溶液的下列说法正确的是
;
⑷ 对于醋酸溶液和醋酸钠溶液的下列说法正确的是
; .醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
 Ag2S(s)+2Cl-(aq) 。
Ag2S(s)+2Cl-(aq) 。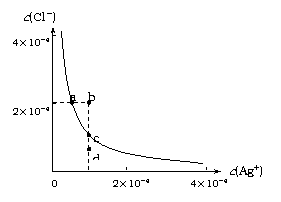 A. 加入NaCl可以使溶液由a点变到b点
A. 加入NaCl可以使溶液由a点变到b点 2NH3(g) △H=-92.4kJ/mol。
2NH3(g) △H=-92.4kJ/mol。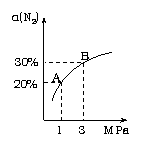 N2的平衡转化率(α-%)与体系总压强(P)的关系
N2的平衡转化率(α-%)与体系总压强(P)的关系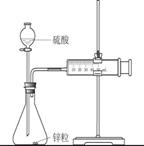
 时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL), 在该温度下,下列说法不正确的是:
时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL), 在该温度下,下列说法不正确的是: