8、酸、碱指示剂本身就是弱酸或弱碱,滴定操作时,弱酸(碱)首先和被滴定的碱(酸)反应,而后过量酸(碱)和指示剂作用变色,显然指示剂的酸碱性较弱,如果指示剂的酸碱性和被滴定的酸碱强度相当,则滴定操作无法进行或误差较大。
沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度比滴定剂和指示剂生成物的溶解度 (填大、小、相同),否则不能用这种指示剂。
如用 AgNO3 溶液滴定溶液中的 Cl-- 的含量时常用 CrO42- 为指示剂,这是因为 AgCl 比 Ag2CrO4 更 溶的缘故,其实难溶性银盐较多,如下表:
|
|
AgCl |
AgBr |
AgCN |
Ag2CrO4 |
AgSCN |
AgF |
|
颜色 |
白 |
浅黄 |
白 |
砖红 |
白 |
白 |
|
溶解度mol/L |
1.34×10-6 |
7.1×10-7 |
1.1×10-8 |
|
1.0×10-6 |
1.6×10-3 |
若用 AgNO3 去滴定 NaSCN 溶液,可选用为滴定的指示剂的物质为
A. NaCl B. BaBr2 C. NaSCN D. Na2CrO4 E. NaF
刚好达到滴定终点时,发生的离子反应方程式为_____________________________________ 9、向少量Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,结果固体完全溶解。
甲同学的解释是:Mg(OH)2(固)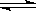 Mg2++2OH-①
Mg2++2OH-①
NH4++H2O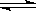 NH3·H2O+H+ ②
NH3·H2O+H+ ②
H++OH-=H2O ③
由于③的发生,使平衡①右移,沉淀溶解。
乙同学的解释是:Mg(OH)2(固)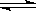 Mg2++2OH-①
Mg2++2OH-①
NH4Cl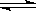 NH4++Cl- ②
NH4++Cl- ②
NH4++OH-=NH3·H2O ③
由于③的发生,使平衡①右移,沉淀溶解。
已知在一定温度下,稀醋酸和稀氨水的电离度相等。
请你用一种试剂,设计一个实验,验证甲或乙的观点的正确性:
Ⅰ、实验步骤: ;
Ⅱ、实验结论: ;
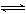 Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s)
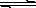 Ca2++2OH-,CaCO3(固)
Ca2++2OH-,CaCO3(固)