0 31118 31126 31132 31136 31142 31144 31148 31154 31156 31162 31168 31172 31174 31178 31184 31186 31192 31196 31198 31202 31204 31208 31210 31212 31213 31214 31216 31217 31218 31220 31222 31226 31228 31232 31234 31238 31244 31246 31252 31256 31258 31262 31268 31274 31276 31282 31286 31288 31294 31298 31304 31312 447348
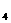 )
)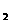 CO
CO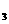 B. NH
B. NH A.CH2Cl2 B.CCl2F2
C. -Br D.CH3COCl
A.CH2Cl2 B.CCl2F2
C. -Br D.CH3COCl

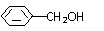
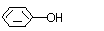 A. 和
B.HC-OCH3和CH3COOH
A. 和
B.HC-OCH3和CH3COOH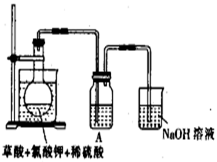 (14分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
(14分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。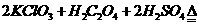
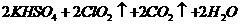
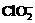 )。饮用水中ClO2、
)。饮用水中ClO2、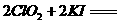
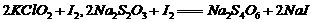 ,则步骤4中加入的指示剂为 ,滴定达到终点时溶液的颜色变化为
,则步骤4中加入的指示剂为 ,滴定达到终点时溶液的颜色变化为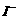 将溶液中的
将溶液中的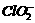 还原为
还原为 以测定其含量,该反应的离子方程式为: 。
以测定其含量,该反应的离子方程式为: 。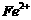 将
将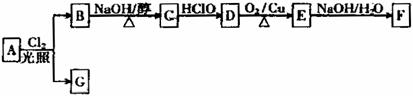 (12分)乙偶姻(F)是一种重要的香料,存在于啤酒中,是酒类调香中一个极其重要的品种。某人工合成乙偶姻的路线如下:
(12分)乙偶姻(F)是一种重要的香料,存在于啤酒中,是酒类调香中一个极其重要的品种。某人工合成乙偶姻的路线如下: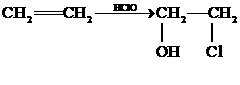
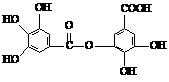 (1)1molA最多可与
mol NaOH反应。
(1)1molA最多可与
mol NaOH反应。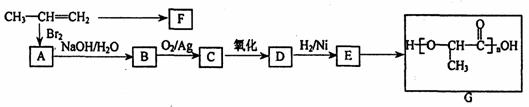 18.(8分)工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
18.(8分)工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。