19.(12分)氢气、纳米技术制成的金属燃料、非金属固体燃料已应用到社会生活和高科技领域。
⑴已知短周期金属元素A和B,其单质单位质量的燃烧热大,可用作燃料。其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
899.5 |
1757.1 |
14848.7 |
21006.6 |
|
B |
738 |
1451 |
7733 |
10540 |
①根据上述数据分析, B在周期表中位于 区,其最高价应为 ;
②若某同学将B原子的基态外围电子排布式写成了ns1np1,违反了 原理;
③B元素的第一电离能大于Al,原因是 ;
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中σ键与π键的数目之比为 。
15.(8分)有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、NO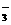 、SO
、SO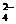 、Cl-、I-、HCO
、Cl-、I-、HCO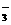 ,进行如下实验:
,进行如下实验:
|
实验步骤 |
实验现象 |
|
①取少量原溶液,加几滴甲基橙 |
溶液变红色 |
|
②取少量原溶液,浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,后在空气中又变成红棕色 |
|
③取少量原溶液,加BaCl2溶液 |
有白色沉淀生成 |
|
④取③中上层清液,加AgNO3溶液 |
有白色沉淀生成,且不溶于HNO3 |
|
⑤取少量原溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
⑴溶液中肯定存在的离子是________________________;
⑵溶液中肯定不存在的离子是________________________;
⑶为进一步确定其他离子,应该补充的实验是________ _ ________;
。
11.下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是
|
|
(I) |
(II) |
|
A |
少量SO2通入Ba(OH)2溶液 |
过量SO2通入少量Ba(OH)2溶液 |
|
B |
少量浓氨水滴入Al2(SO4)3溶液 |
少量Al2(SO4)3溶液滴入浓氨水 |
|
C |
0.1mol Cl2通入含0.2mol FeBr2的溶液 |
0.3 molCl2通入1L 0.2 mol•L-1 FeBr2溶液中 |
|
D |
过量BaCl2溶液与少量Na2SO4溶液相混合 |
少量Ba(OH)2溶液与过量MgSO4溶液相混合 |
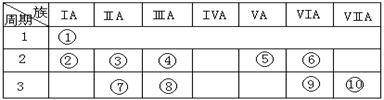
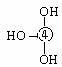 ⑸元素④的含氧酸的结构式可表示为 则可判断该酸为 酸(填强或弱)
⑸元素④的含氧酸的结构式可表示为 则可判断该酸为 酸(填强或弱) Cl
Cl
Cl
Cl
Cl
Cl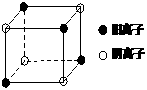 ⑵在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体的晶体类型为
;
⑵在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体的晶体类型为
;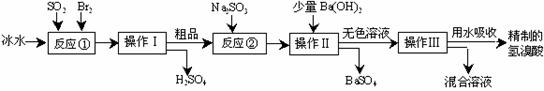 ⑴反应①中发生反应的化学方程式为
;
⑴反应①中发生反应的化学方程式为
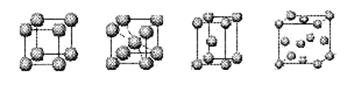
;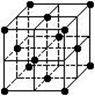 图所示(一个小黑点代表一个C60分子),下列说法正确的是
图所示(一个小黑点代表一个C60分子),下列说法正确的是 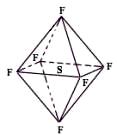 A.含有阴离子的晶体中必含有阳离子
A.含有阴离子的晶体中必含有阳离子