0 30079 30087 30093 30097 30103 30105 30109 30115 30117 30123 30129 30133 30135 30139 30145 30147 30153 30157 30159 30163 30165 30169 30171 30173 30174 30175 30177 30178 30179 30181 30183 30187 30189 30193 30195 30199 30205 30207 30213 30217 30219 30223 30229 30235 30237 30243 30247 30249 30255 30259 30265 30273 447348

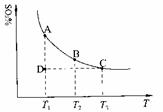 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)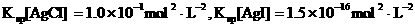 )
)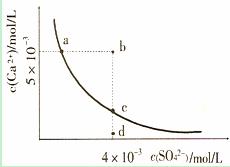 已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO
已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO .某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中不正确的是
.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中不正确的是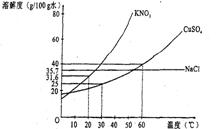 下图是几种盐的溶解度曲线,根据曲线判断下列说法正确的是
下图是几种盐的溶解度曲线,根据曲线判断下列说法正确的是