23. 某研究性学习小组成员,利用稀硫酸与某金属的反应来探究影响化学反应速率的因素,下表是研究过程中记录的实验数据:(表中某些数据记录已模糊不清,个别数据已丢失。)
 实验 实验序号 |
金属 质量/g |
金属 状态 |
c(H2SO4) /mol·L-1 |
v(H2SO4) /mL |
溶液温度/°C |
金属消失的时间/s |
|
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
数据模糊1 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
数据模糊2 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
数据模糊3 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
数据模糊4 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
数据丢失 |
44 |
40 |
若实验操作、数据记录均是正确的,请分析上述数据,回答下列问题:
(1)该实验主要是探究 因素对反应速率的影响。
(2)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理。数据模糊1 ,2 ,3 ,4 。
(3)试猜测实验9反应前溶液的温度约为 °C。推测的依据是 。
20.(5分)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g)  CO(g)+H2O(g),平衡常数K与温度t 0C的关系如下表:
CO(g)+H2O(g),平衡常数K与温度t 0C的关系如下表:
|
t 0C |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(1)该反应的化学平衡常数表达式为 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
A、容器中压强不变 B、混合气体中c(CO)不变
C、v(正,H2)=v(逆,H2O) D、c(CO2)= c(CO)
18.(3分)甲烷在高温下与水蒸气反应,反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O(g)在高温下反应的热化学方程式 。


 CH3OH(g),经过5min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L。求:
CH3OH(g),经过5min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L。求: (8分)可逆反应:aA(g)+
bB(g)
(8分)可逆反应:aA(g)+
bB(g) (5分)对于A+2B(g) n C(g)在一定条件下达到平衡后,改变下列条件请回答:
(5分)对于A+2B(g) n C(g)在一定条件下达到平衡后,改变下列条件请回答: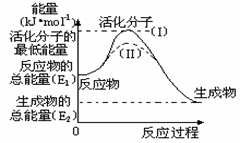 (7分)在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示。请认真观察右图,然后回答问题。
(7分)在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示。请认真观察右图,然后回答问题。