15(16分)、25℃时,将0.1molCH3COONa和0.05molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①
②
③ 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.1mol/L的是 ,浓度为0.05mol/L的是 。
(4) 和 两种粒子物质的量之和等于0.1mol。
16(12分)、某学生用中和滴定法测定某烧碱的纯度。实验如下:
(1)配制待测液:用已经称好的5.00g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制成1000mL的溶液,除烧杯外,还需要的玻璃仪器有 (填序号)。
①天平、②蒸发皿、③玻璃棒、④100mL容量瓶、⑤1000mL容量瓶、⑥胶头滴管、⑦试管
(2) 用标准 0.10 mol/L的盐酸溶液滴定NaOH溶液的实验操作如下:
A.用碱式滴定管取稀NaOH溶液 20 .00mL,注入锥形瓶中,加入甲基橙指示剂。
B.用待测定的NaOH溶液润洗碱式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2-3 cm处,再把酸式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶装稀NaOH溶液,重复滴定操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用字母序号填写):()→()→()→()→D→()→()。
②滴定时 手旋转酸式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴入一滴标准盐酸时溶液立即由 色变成 色, 且半分钟内不变色,则达到滴定终点。
(3)酸式滴定管用蒸馏水洗后,未用标准液润洗,导致滴定计算结果NaOH溶液浓度(填“偏小”、“偏大”或“无影响”,下同) ;酸式滴定管读数时,若先俯后仰,则计算结果NaOH溶液浓度会 。装NaOH溶液的锥形瓶中原来有少量水则结果会 。
17(10分)、从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
|
溶度积 |
2.8×10-9 |
6.8×10-6 |
5.5×10-6 |
1.8×10-11 |
(1)在从海水中提取镁时,首先要把海水中的镁离子转化为沉淀,往往用到贝壳(主要成份是碳酸钙),如果将贝壳研磨成粉末直接投入浓缩的海水中,你认为 (填“能”或“不能”) 将镁离子转化为MgCO3沉淀;如果不能直接投入,应将贝壳作何处理 (如前面选“能”,此处不用回答)。
(2)某同学在实验室条件下模拟该生产过程,他打算用烧碱把海水中的镁离子转化为沉淀。在加试剂时,他误将纯碱溶液加入海水中,他思考了一下,又在得到的混合液中加入过量的烧碱溶液,你认为他最终得到的沉淀是 ,实验过程所发生反应的离子方程式为 。
(3)已知海水中镁离子浓度为1.8×10-3mol/L,则要使镁离子产生沉淀,溶液的PH最低应为 。
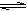 Fe(OH)3 + 3H+ B.Br-+ H2O
Fe(OH)3 + 3H+ B.Br-+ H2O 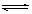 H+
+ OH-向右移动,且使溶液呈酸性的是
H+
+ OH-向右移动,且使溶液呈酸性的是