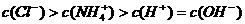1.(镇江市09第二次调研测试)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
|
酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
|
Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断下列说法正确的是
A.在冰醋酸中这四种酸都没有完全电离 B.在冰醋酸中高氯酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2 H+ +SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
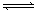 H+ +OH-,若要使水溶液的酸性增强,并使水的电离程度增大,应加入的物质是
H+ +OH-,若要使水溶液的酸性增强,并使水的电离程度增大,应加入的物质是
 请回答:
请回答: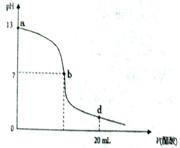 常温下,向20 mL 氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示:
常温下,向20 mL 氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示: (Na
(Na )
)
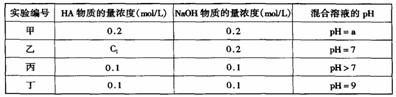
 )(填”>”、“<”或“=”)
)(填”>”、“<”或“=”) 、
、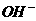 的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=一lgc(
的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=一lgc(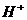 ),pCl=一lgc(
),pCl=一lgc(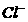 的浓度大于0.1mol/L)
中汞元素的主要存在形态是 。少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是
。
的浓度大于0.1mol/L)
中汞元素的主要存在形态是 。少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是
。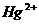 的废水。反应的离子方程式为 。
的废水。反应的离子方程式为 。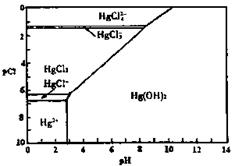 c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)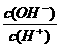 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是 A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1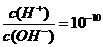 的溶液中:K’、Na+、CO32-、AIO2-
的溶液中:K’、Na+、CO32-、AIO2-