18.(11分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应正向为ΔH ▲ 0;若该正向反应在某一温度压强下不自发进行,推测其熵变ΔS ▲ 0(选填“<”或“>”)。
(2)能判断该反应达到化学平衡状态的依据是 ▲ (多选扣分)。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ▲ ℃。其它条件不变,升高温度,原化学平衡向 ▲ 反应方向移动(填“正”或“逆”),容器内混合气体的密度 ▲ (填“增大”、“减小”或“不变”),气体平均相对分子质量 ▲ (填“增大”、“减小”或“不变”)。
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡。若反应开始时CO与H2O的浓度分别为0.200 mol·L–1和0.100 mol·L–1,平衡时CO的转化率
▲ 。
16.(10分)已知1mol某链状酯A在酸性条件下完全水解,生成2mol B和1molC
|
|




 Δ
Δ
|
|


|


(1)写出结构简式:C ▲ 、D ▲
(2)已知B与NaOH溶液反应生成F,F与稀硫酸反应生成G,在催化剂条件下进行聚合,生成链状高分子H。
写出G→H的化学方程式 ▲ 。
(3)写出G的二种同分异构体的结构简式 ▲
(4)写出A与足量NaOH溶液共热的化学方程式 ▲ 。
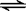 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为( )
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为( )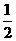 O2 (g);
O2 (g); H= +242kJ·mol-1
H= +242kJ·mol-1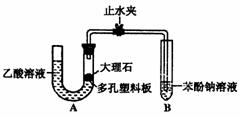 (14分)某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱和证明乙酸溶液中存在电离平衡,进行了下述一些实验:
(14分)某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱和证明乙酸溶液中存在电离平衡,进行了下述一些实验: