27.(1)在纯碱溶液中滴入酚酞,溶液变红,若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是_________________,其原因是(以离子方程式和简要的文字说明)___________________________________________________________________。
(2)在同温同压下,测得三种弱酸不同浓度时的电离度,列表如下:
|
酸 |
HA |
HB |
HC |
|||
|
物质的量浓度(mol/L) |
0.1 |
0.15 |
1 |
1.5 |
1 |
2 |
|
电离度 |
0.2% |
0.1% |
0.2% |
0.1% |
10% |
6% |
根据以上数据判断,三种酸由强到弱的顺序是_________________.
(3)重水的离子积c(D+) c(OD-)为1.6×10-15,可以用pH一样的定义来规定pD=-lgc(D+)。在100 mL 0.25 mol/L的DCl的重水溶液中加入50 mL 0.2 mol/L的NaOD的重水溶液(不考虑混合后体积变化),混合溶液的pD为_____________。
26.反应CaCO3 CaO+CO2在不同温度下,CO2的平衡压强如下表:
CaO+CO2在不同温度下,CO2的平衡压强如下表:
|
温度/℃ |
550 |
650 |
750 |
850 |
897 |
|
压强/Pa |
5.32×10 |
9.17×102 |
8.37×103 |
4.34×104 |
1.01×105 |
根据上表数据,填写下列空白:
(1)若升高原CaCO3分解平衡体系的温度,同时给反应容器加压,则原平衡__________.
A.向逆反应方向移动 B.向正反应方向移动
C.不移动 D.无法确定平衡移动方向
(2)在一个不与外界进行热交换的密闭容器中,足量的CaCO3在850℃时建立分解平衡。若将该容器的容积扩大原来的2倍,需重新达到平衡时,容器内的温度将_____________,CaCO3的分解率是_________,CO2的平衡压强将_________4.34×104Pa 填>、=或<
填>、=或< ,其理由是_____________________________________________________________。
,其理由是_____________________________________________________________。
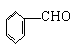
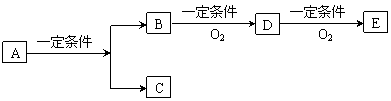 (10分)有下列转化关系:
(10分)有下列转化关系:
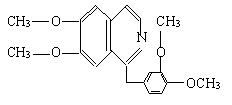
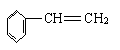 B.苯甲酸
B.苯甲酸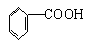
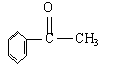 D.苯甲醛
D.苯甲醛