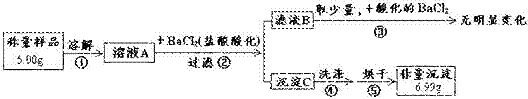
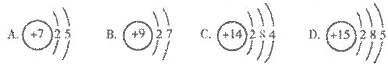0 25068 25076 25082 25086 25092 25094 25098 25104 25106 25112 25118 25122 25124 25128 25134 25136 25142 25146 25148 25152 25154 25158 25160 25162 25163 25164 25166 25167 25168 25170 25172 25176 25178 25182 25184 25188 25194 25196 25202 25206 25208 25212 25218 25224 25226 25232 25236 25238 25244 25248 25254 25262 447348
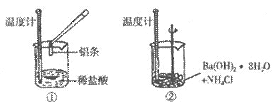 (1)实验中发现:反应后①中的温度升高、②中的温度降低。由此判断铝与盐酸的反应是_______热反应、Ba(OH)2·8H2O与NH4Cl的反应是_______热反应。
(2)①中反应的离子方程式为_________________________;在该反应中,还原剂是_______。
10.(4分)某同学在实验室制取氨气的实验装置如图所示。
(1)实验中发现:反应后①中的温度升高、②中的温度降低。由此判断铝与盐酸的反应是_______热反应、Ba(OH)2·8H2O与NH4Cl的反应是_______热反应。
(2)①中反应的离子方程式为_________________________;在该反应中,还原剂是_______。
10.(4分)某同学在实验室制取氨气的实验装置如图所示。 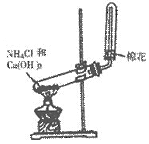
 CH
CH  CH3-CH2OH
CH3-CH2OH
 D.CH3CH2OH
D.CH3CH2OH CH2=CH2↑+H2O
17.下列各组物质中,常温下发生反应并放出红棕色气体的是(
)
A.铜和浓硫酸 B.铜和浓硝酸 C.铜和浓盐酸
D.铁和稀硫酸
18.在标准状况下,32g甲烷气体的体积约为( )
A.5.6L B.11.2L C.22.4L D.44.8L
19.下列试剂可用于检验溶液中Cl-的是(
)
A.紫色石蕊试液 B.硝酸银溶液和稀硝酸 C.澄清石灰水
D.硝酸钡溶液和稀硝酸
20.下列说法中,不正确的是( )
A.氨气可用于制造氮肥 B.氯气可用于消毒和制造漂白粉 C.蔗糖可以食用 D.用工业酒精勾兑的白酒可以饮用
21.下列实验操作中,正确的是( )
A.用托盘天平称量药品时,左盘放药品,右盘放砝码
CH2=CH2↑+H2O
17.下列各组物质中,常温下发生反应并放出红棕色气体的是(
)
A.铜和浓硫酸 B.铜和浓硝酸 C.铜和浓盐酸
D.铁和稀硫酸
18.在标准状况下,32g甲烷气体的体积约为( )
A.5.6L B.11.2L C.22.4L D.44.8L
19.下列试剂可用于检验溶液中Cl-的是(
)
A.紫色石蕊试液 B.硝酸银溶液和稀硝酸 C.澄清石灰水
D.硝酸钡溶液和稀硝酸
20.下列说法中,不正确的是( )
A.氨气可用于制造氮肥 B.氯气可用于消毒和制造漂白粉 C.蔗糖可以食用 D.用工业酒精勾兑的白酒可以饮用
21.下列实验操作中,正确的是( )
A.用托盘天平称量药品时,左盘放药品,右盘放砝码  B.用烧杯作容器,给液体物质加热时,不需要垫石棉网
C.氢氧化钠固体在烧杯中溶解后,立即将溶液注入到容量瓶中
B.用烧杯作容器,给液体物质加热时,不需要垫石棉网
C.氢氧化钠固体在烧杯中溶解后,立即将溶液注入到容量瓶中  Na2CO3+CO2↑+H2O
24.当稀硫酸与稀氢氧化钠溶液恰好完全中和时,一定相等的量是(
)
A.原溶液中,H2SO4和NaOH的质量 B.原溶液中,H2SO4和NaOH的物质的量
C.原溶液中,H+和OH-的物质的量浓度 D.原溶液中,H+和OH-的物质的量
25.一定条件下,在2L的密闭容器中通入4.0mol的氮气和适量的氢气,发生反应:N2(g)+3H2(g)
Na2CO3+CO2↑+H2O
24.当稀硫酸与稀氢氧化钠溶液恰好完全中和时,一定相等的量是(
)
A.原溶液中,H2SO4和NaOH的质量 B.原溶液中,H2SO4和NaOH的物质的量
C.原溶液中,H+和OH-的物质的量浓度 D.原溶液中,H+和OH-的物质的量
25.一定条件下,在2L的密闭容器中通入4.0mol的氮气和适量的氢气,发生反应:N2(g)+3H2(g) 2NH3(g)。经过5s后,测得氮气还剩余3.0mol,在这5s内氮气的反应速率为(
)
A.0.6mol/(L·s) B.0.5mol/(L·s) C.0.1mol/(L·s) D.0.05mol/(L·s)
2NH3(g)。经过5s后,测得氮气还剩余3.0mol,在这5s内氮气的反应速率为(
)
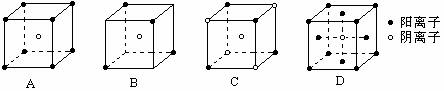
A.0.6mol/(L·s) B.0.5mol/(L·s) C.0.1mol/(L·s) D.0.05mol/(L·s)  2Fe+3CO2 ②2Al+Fe2O3
2Fe+3CO2 ②2Al+Fe2O3 Fe3O4+4H2
7.(6分)X、Y、Z代表三种短周期元素,其原子序数依次减小。X元素原子的次外层电子数是最外层电子数的
Fe3O4+4H2
7.(6分)X、Y、Z代表三种短周期元素,其原子序数依次减小。X元素原子的次外层电子数是最外层电子数的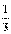 ,Y元素原子的核外电子总数与其最外层电子数之比为3∶2,Z元素原子的电子层数等于其核外电子数。现有甲、乙、丙三种中学化学中常见的物质,均由X、Y、Z元素中的两种或三种组成。
请回答:
(1)甲物质只含有两种元素,在标准状况下为气态,实验测知甲在标准状况下的密度为1.25g/L。用甲直接合成的高分子化合物是一种生活中常见的塑料,该合成反应的化学方程式为______________________。
(2)乙物质含有三种元素,其中X、Y、Z三种元素的质量比为4∶6∶1,乙物质氧化可得到丙(丙的相对分子质量为60)。在实验室可用新制Cu(OH)2悬浊液检验乙分子中的官能团,简述实验操作方法和现象:_______________。
(3)丙物质水溶液呈弱酸性,其电离方程式为_______________________________。
二、实验题(共18分)
8.(4分)在实验室制备乙烯的装置如图所示,仪器A的名称是_______,A中加入的两种试剂分别是_______和_______,收集乙烯的方法是__________。
,Y元素原子的核外电子总数与其最外层电子数之比为3∶2,Z元素原子的电子层数等于其核外电子数。现有甲、乙、丙三种中学化学中常见的物质,均由X、Y、Z元素中的两种或三种组成。
请回答:
(1)甲物质只含有两种元素,在标准状况下为气态,实验测知甲在标准状况下的密度为1.25g/L。用甲直接合成的高分子化合物是一种生活中常见的塑料,该合成反应的化学方程式为______________________。
(2)乙物质含有三种元素,其中X、Y、Z三种元素的质量比为4∶6∶1,乙物质氧化可得到丙(丙的相对分子质量为60)。在实验室可用新制Cu(OH)2悬浊液检验乙分子中的官能团,简述实验操作方法和现象:_______________。
(3)丙物质水溶液呈弱酸性,其电离方程式为_______________________________。
二、实验题(共18分)
8.(4分)在实验室制备乙烯的装置如图所示,仪器A的名称是_______,A中加入的两种试剂分别是_______和_______,收集乙烯的方法是__________。 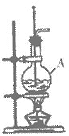
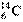 具有放射性。在考古研究中,可通过测定
具有放射性。在考古研究中,可通过测定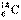 的含量来判断古化石的地质年代。
的含量来判断古化石的地质年代。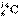 原子核内的中子数是( )
A.6 B.8 C.14 D.20
11.将少量氯水加入到下列溶液中,溶液呈蓝色的是(
)
A.KI溶液 B.淀粉溶液 C.KI和淀粉的混合溶液 D.NaOH溶液
12.环境污染已成为人类社会面临的重大威胁,下列情况不会造成环境污染的是(
)
A.工业上大量燃烧含硫燃 B.随意抛弃塑料垃圾 C.汽车尾气大量排放 D.开发使用新能源氢气
13.下列原子结构示意图中,表示氮原子的是(
)
原子核内的中子数是( )
A.6 B.8 C.14 D.20
11.将少量氯水加入到下列溶液中,溶液呈蓝色的是(
)
A.KI溶液 B.淀粉溶液 C.KI和淀粉的混合溶液 D.NaOH溶液
12.环境污染已成为人类社会面临的重大威胁,下列情况不会造成环境污染的是(
)
A.工业上大量燃烧含硫燃 B.随意抛弃塑料垃圾 C.汽车尾气大量排放 D.开发使用新能源氢气
13.下列原子结构示意图中,表示氮原子的是(
)