23.(14分)实验是化学的最高法庭。以镁、铝为电极,稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为此进行了如下探究实验:如图,剪取大小相近的镁条和铝片,用砂纸去膜,使镁与铝分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。
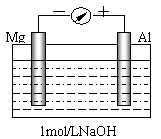 根据以上实验现象,回答下列问题:
根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是_____ ▲ __
(填“Mg”或“Al”)片;
负极反应式是 ▲ 。
(2)随后阶段,铝片发生的电极反应式是______ ▲ ____;
镁条表面只有极少量的气泡产生,其原因之一是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:__________ ▲ _____;
铝片表面气泡有所减少,但未消失,产生这一现象的原因可能是
▲ 。
(3)该研究性学习小组用铝片分别与c(H+)均为3 mol/L的稀盐酸和稀硫酸反应:
实验过程:往装有相同铝片的2支试管中分别加入等体积,且c(H+)=3.0 mol/L的盐酸和硫酸,观察反应进行到1、2、5、15、20 min时铝片与酸反应的情况。
实验结果如下表:
|
反应进程(min) |
1 |
2 |
5 |
15 |
20 |
|
盐酸 |
少量气泡 |
较多 气泡 |
大量 气泡 |
反应 剧烈 |
铝片 耗尽 |
|
硫酸 |
均无明显现象 (无气泡产生) |
|
通过上述实验可知,铝片与盐酸和硫酸反应存在较大的差异。这和课本中“铝能与稀盐酸和稀硫酸反应生成氢气”的说法不一致。假如你将开展实验,探究铝片分别与稀盐酸和稀硫酸反应差异的原因,为设计实验,你将对差异的原因作出哪些假设或猜想?你的假设(猜想)是: ___ ▲ ;
铝片与3 mol/L的稀盐酸反应时,产生H2的速率经过由慢到快再慢的过程的原因是__ ▲ 。
江苏省平潮高级中学2006-2007学年度第一学期期中考试
21.(8分)将化学知识系统化,有助于对化学问题的进一步认识和理解。
资料1:化学反应的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
资料2:化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
资料3:化学反应的能量变化(ΔH)与反应物和生成物的键能有关。在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。
根据以上资料回答下列问题:
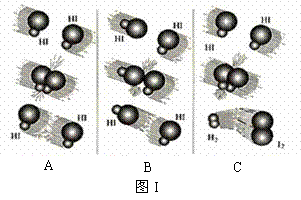
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
 ▲ (选填“A”、“B”或“C”);
▲ (选填“A”、“B”或“C”);
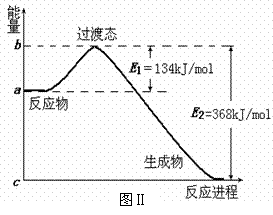
(2)图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
▲ ;
(3) 下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/
kJ·mol–1 |
197 |
360 |
499 |
X |
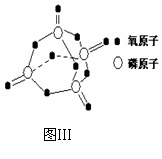
 已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中X=
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中X=
▲ 。
(4)图Ⅳ为氧族元素的氢化物a、b、c、d的生成
热数据示意图。请你归纳:非金属元素的氢化物的稳
定性与氢化物的生成热(△H)之间的关系:
▲ 。
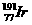 ,则其核内的中子数是
,则其核内的中子数是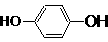 ____ ▲
__;
____ ▲
__;
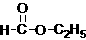 ____ ▲ __。
____ ▲ __。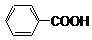 的一种同分异构体的结构简式____ ▲ ___;
的一种同分异构体的结构简式____ ▲ ___;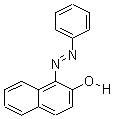 苏丹黄[1-(苯基偶氮)基-2-萘酚]的结构如下:
苏丹黄[1-(苯基偶氮)基-2-萘酚]的结构如下: