29.(10分)(1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O===4Al(OH) 3,负极为 ,负极发生 反应(填“氧化”或“还原”),负极反应 ;正极为铂网, (填“电子”或“电流”)从铂极流出;海水为电解质溶液,海水中的Na+移向 (填“正极”或“负极”)。
(2)航天技术使用氢氧电池具有高能、轻便,不污染优点,氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均可表示为:2H2+O2===2H2O。酸式氢氧燃料电池的电解质是酸,其负极反应为:2H2-4e-===4H+,则正极反应为 ;碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-==4OH-,则负极反应为: 。
|
|
 (3)蓄电池Pb+PbO2+2H2SO4 2PbSO4+2H2O放电时,正极电极反应式 ,当电
(3)蓄电池Pb+PbO2+2H2SO4 2PbSO4+2H2O放电时,正极电极反应式 ,当电
路中通过0.5mol电子时,消耗H2SO4的物质的量 ,负极增重 g

|
|
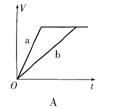
 2NO2 (g),如图所示。
2NO2 (g),如图所示。
(1)曲线 (填“X”或“Y”)表示NO2的物质的量
随时间的变化曲线。
(2)若升高温度,则v(正) ,v(逆)
|
|
|
中v(NO2)=0.3 mol·L-1·min-1,乙中v (N2O4)=0.2 mol·L-1·min-1,则 中反应更快。
(4)在0到1 min中内用X表示该反应的速率是 ,
该反应达最大限度时,Y的转化率 ,反应开始时与反应达平衡状态时的压强之比为 。
(5)下列描述能表示反应达平衡状态的是 。
A.容器中X与Y的物质的量相等 B.容器内气体的颜色不再改变
C.容器的压强保持一定 D.容器内气体的平均相对分子质量不再改变
E.2v(X)=v(Y)
(6)若1 mol N2O4完全转化为2 mol NO2 (g)时吸收QKJ的热量,在一密闭容器中充入2 mol NO2 (g),容器内温度 (升高、降低或不变)。达到反应限度时反应产生的热量
QKJ(大于、小于或等于)。
绵阳中学高2013级第二学期半期考试
26.(10分)元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下面是八种短周期元素的相关信息(已知铍的原子半径为0.089 nm)
|
元素代号 |
A |
B |
C |
D |
E |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.099 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6,-2 |
-1 |
-2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色
(1)B元素在元素周期表中的位置 。
(2)上述五种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式)。
(3)用电子式表示A、D形成化合物的过程: 。
(4)H、E形成原子个数比为1∶1的化合物为 (填化学式),含有的化学键类型为 。
(5)F与G形成的最简单的化合物的电子式 ,该分子的空间构型为 。
(6)E的氢化物比C的氢化物的熔沸点高的原因是 。
(7)在有饱和食盐水的水槽中,用一倒扣在水槽中的试管用排饱和食盐水法先后收集等体积的GF4和D的单质气体,在光照条件下可观察到水槽中有晶体析出,试管内气体颜色逐渐变浅,液面上升, , 等现象产生



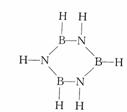 环状结构(BHNH)3称为无机苯,它和苯是等电子体,
环状结构(BHNH)3称为无机苯,它和苯是等电子体, 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化( )