8.若将含HCl 0.20 mol的稀盐酸滴入0.15 mol Na2CO3的溶液中,经充分反应后,溶液中各溶质的物质的量为(单位:mol)( )
|
|
Na2CO3 |
HCl |
NaCl |
NaHCO3 |
|
A |
0 |
0 |
0.05 |
0.10 |
|
B |
0.5 |
0 |
0.20 |
0 |
|
C |
0 |
0 |
0.20 |
0.10 |
|
D |
0 |
0.05 |
0.15 |
0.15 |
思路解析:盐酸和Na2CO3反应,与滴加顺序有关,应引起足够重视。
分析本题可知两条重要信息:(1)因稀盐酸是滴入到Na2CO3溶液中的,所以这种情况下盐酸和碳酸钠的反应是分步进行的:
Na2CO3+HCl====NaCl+NaHCO3①
NaHCO3+HCl====NaCl+CO2↑+H2O ②
(2)反应物盐酸的量相对于Na2CO3的第一步反应是过量的(余0.05 mol),相对于Na2CO3的完全反应是不足量的(差0.10 mol)。这样利用题示信息进一步分析可知:充分反应后反应物Na2CO3和HCl都已消耗完全;两步反应中的HCl都转化为NaCl,其转化关系为1∶1(物质的量之比)。因此生成的NaCl为0.2 mol;而NaHCO3的量则经一步反应生成0.15 mol(按不足量),第二步反应又转化了(放CO2)0.05 mol,最后剩0.10 mol。
答案:C
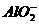 ,实际存在[Al(OH)4]-。200
mL 0.2 mol·L-1 Na[Al(OH)4]溶液与250 mL 0.2 mol·L-1 H2SO4混合,完全反应后,溶液中Al3+与
,实际存在[Al(OH)4]-。200
mL 0.2 mol·L-1 Na[Al(OH)4]溶液与250 mL 0.2 mol·L-1 H2SO4混合,完全反应后,溶液中Al3+与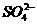 物质的量之比为( )
物质的量之比为( )