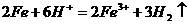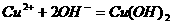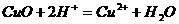0 22566 22574 22580 22584 22590 22592 22596 22602 22604 22610 22616 22620 22622 22626 22632 22634 22640 22644 22646 22650 22652 22656 22658 22660 22661 22662 22664 22665 22666 22668 22670 22674 22676 22680 22682 22686 22692 22694 22700 22704 22706 22710 22716 22722 22724 22730 22734 22736 22742 22746 22752 22760 447348
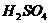 滴在铁片上:
滴在铁片上: