19.(15分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、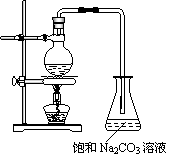 纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH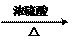 CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)若用右图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为:_____________________ _____、______________________________等。
(2)此反应以浓硫酸为催化剂,可能会造成____________、_________等问题。
(3)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
|
同一反应时间 |
同一反应温度 |
||||
|
反应温度/℃ |
转化率(%) |
选择性(%) |
反应时间/h |
转化率(%) |
选择性(%) |
|
40 |
77.8 |
100 |
2 |
80.2 |
100 |
|
60 |
92.3 |
100 |
3 |
87.8 |
100 |
|
80 |
92.6 |
100 |
4 |
92.3 |
100 |
|
120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
|
选择性100%表示反应生成的产物是乙酸乙酯和水 |
根据表中数据,下列__________(填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
18.(19分)a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
4核 |
单核 |
5核 |
3核 |
|
带电荷数(单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:(1)a粒子的核外电子排布式
(2) b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 >
(用化学式表示)
(3) d溶于水的电离方程式
(4) g粒子所构成的化学键类型属
(5) c粒子是 ,f粒子是 (用化学式表示)
10.已知下列元素的半径为:
|
原子 |
N |
S |
O |
Si |
半径r/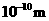 |
0.75 |
1.02 |
0.74 |
1.17 |
根据以上数据,磷原子的半径可能是( )
A.0.80×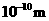 B.1.10×
B.1.10×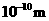
C.1.20×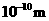 D.0.70×
D.0.70×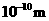
 设NA表示阿伏加德罗常数,下列叙述中不正确的是( )
设NA表示阿伏加德罗常数,下列叙述中不正确的是( )