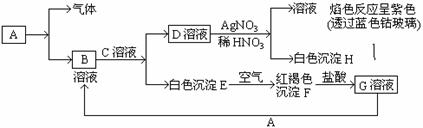
0 21996 22004 22010 22014 22020 22022 22026 22032 22034 22040 22046 22050 22052 22056 22062 22064 22070 22074 22076 22080 22082 22086 22088 22090 22091 22092 22094 22095 22096 22098 22100 22104 22106 22110 22112 22116 22122 22124 22130 22134 22136 22140 22146 22152 22154 22160 22164 22166 22172 22176 22182 22190 447348
 (CN)2、(SCN)2……称为类卤素,CN-、OCN-、SCN-……称为类卤离子,下列关于(CN)2的反应中哪一种不象卤素的反应
(CN)2、(SCN)2……称为类卤素,CN-、OCN-、SCN-……称为类卤离子,下列关于(CN)2的反应中哪一种不象卤素的反应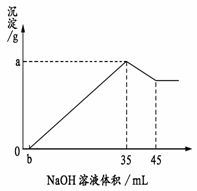 (6分)取6 g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如右图所示。 试求:
(6分)取6 g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如右图所示。 试求:
 105Pa)的体积。
105Pa)的体积。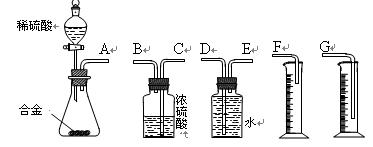
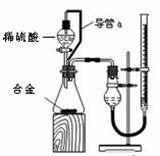 A.待实验装置冷却后再读数
A.待实验装置冷却后再读数