33.(6分)某化学活动小组用稀盐酸对赤铁矿Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液。为防止直接排放造成环境污染,对其组成进一步进行探究。过滤该残液,取100 g 滤液,向基中不断加入5%和氢氧化钠溶液,所得实验数据如下表:
|
加入氢氧化钠的溶液的质量/g |
20 |
40 |
60 |
80 |
160 |
180 |
|
生成沉淀的质量/g |
0 |
0 |
0.80 |
1.78 |
5.35 |
5.35 |
(1) 通过对上述实验数据的分析,该滤液中含有的溶质是--------------(写化学式)。
(2) 选择合理的数据,计算100 g 滤液中溶质的质量(若有多种溶质,任选一种。结果精确到0.01g)。
可能用到的相对原子质量:H-1 O-16 Na -23 Cl-35.5 Fe -56
32.(6分)现有甲、乙两包白色固体,已知甲中含有NaCl、NaNO3、NaCO3、NaOH中的一种或几种,乙为纯净物,是初中化学学习中涉及到的物质。为了证明甲、乙两包固体的成分,现进行如下实验:
(1)实验一
|
操作步骤 |
实验现象 |
结论 |
|
①取甲中少量粉末加足量水充分溶解 |
溶液呈无色 |
---------- |
|
②取①中所得溶液少量,滴加紫色石蕊试液 |
石蕊试液变了蓝色 |
溶液pH----7(填“>”、“<”或“=” |
|
③另取①中所得溶液少量,滴加稀盐酸 |
无明显现象 |
甲中一定含有------(填化学式,下同),一定不含有------,可能含有--------。 |
(2)实验二(部分物质在流程图中未列出)
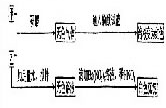
根据以上实验推断,乙物质为-----------(填写化学式),使用该物质时应注意---------------。
27.(3分)有些金属的氢氧化物有相似的化学性质,但物理性质却有所不同,如Ca(OH)2,Ba(OH)2的溶解度就存在一定的差异,如下表所示:
|
温度/℃ |
0 |
40 |
80 |
|
|
溶解度/g |
Ca(OH)2 |
0.187 |
0.141 |
0.094 |
|
Ba(OH)2 |
1.67 |
8.22 |
101.4 |
根据以上信息回答下列问题。
(1) 下图中,表示Ca(OH)2溶解度曲线的是-----------( 填“A”或“B”)。
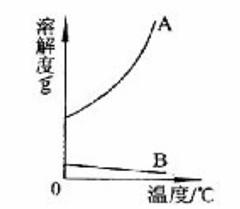
(2) 如果要将Ca(OH)2的不饱和溶液转为饱和溶液,可采取的方法是--------------(只举一种)
(3) 现有常温时含Ca(OH)2,Ba(OH)2两种溶质的某饱和溶液,若要得到较纯净的Ba(OH)2溶液,采取的物理方法为-----------------。
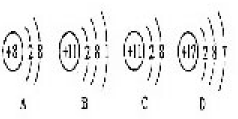

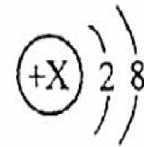 某离子带2个单位正电荷,
某离子带2个单位正电荷, A.防止噪声产生
A.防止噪声产生