25.(15分)现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
   |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
-2 |
|
|
-3 |
-1 |
|
-3 |
|
回答下列问题:
(1)③的元素符号是 ,⑧的元素名称是 。
①在元素周期表中的位置是(周期、族) 、 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___ ____;
碱性最强的化合物的电子式是:____ _________;
(3)比较④和⑦的氢化物的稳定性
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式
。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式
。
24.(10分)A、B、C、D、E五种短周期元素,已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和,B原子最外层电子数比其次外层电子数多2;在元素周期表中,C是E的邻族元素;D和E的原子序数之和为30。它们两两形成的化合物有甲、乙、丙、丁四种,这四种化合物中原子个数之比如下表:
|
甲 |
乙 |
丙 |
丁 |
|
A:C=1:1 |
B:A=1:4 |
D:E=1:3 |
B:E=1:4 |
(1)写出丁的化学式:
(2)写出乙的电子式:
(3)利用甲的水溶液可以处理空气中的SO2 ,并生成一种强酸。请写出该反应的化学方程式: 。
(4)向丙的水溶液中滴入NaOH溶液,直到过量,可观察到的现象是: 、
请写出相关反应的离子方程式:
(1)CCl4 (2)略(3)H2O2+SO2=H2SO4
(4)先有白色沉淀生成,后沉淀溶解;
Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O
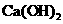 C.
C.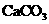 D.
D.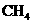

 。(5)H2O2(答PH3同样给分)。
。(5)H2O2(答PH3同样给分)。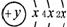 ,B、C可形成离子化合物B3C2,下列有关叙述正确的是( )
,B、C可形成离子化合物B3C2,下列有关叙述正确的是( )