1﹒孔林、孔庙、孔府是著名的旅游景点,近几年,修建的高速公路绕开了孔林、孔庙、孔府,以减少污染。你认为,在三孔景区,这样能有效减少的主要是
A﹒车辆排放的大气尾气 B﹒居民燃煤所产生SO2气体
C﹒车辆尘埃、生活垃圾 D﹒工厂所排“三废”
2﹒下列每组分别给出了两个量,其中可以组成一个物质的量的公式的组有
|
① |
② |
③ |
④ |
⑤ |
|
物质微粒数 |
固体体积 |
溶液的质量百分比浓度 |
标准状况下气体的摩尔体积 |
非标准状况下某物质的质量 |
|
阿伏加德罗常数 |
固体密度 |
溶液体积 |
标准状况下气体的体积 |
物质的摩尔质量 |
A﹒①②⑤ B﹒②③④ C﹒①④⑤ D﹒①③④
3﹒物质分类的依据通常是根据它的组成和性质,下列物质的分类中,只考虑组成的是
A﹒硫酸钠是钠盐、硫酸盐、正盐
B﹒二氧化硫是氧化物、酸酐、有漂白性物质
C﹒氢氧化钠是一元碱、易溶性碱、强碱
D﹒碳酸氢钠是钠盐、酸式盐、易分解的盐
4﹒“纳米材料”是粒子直径为1nm-100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质①是溶液 ②是胶体 ③具有丁达尔现象 ④不能透过半透膜 ⑤不能透过滤纸 ⑥静止后会出现黑色沉淀。其中正确的是
A﹒①④⑥ B﹒②③⑤ C﹒②③④ D﹒①③④⑥
5﹒下列离子方程式改写成化学方程式正确的是
A﹒Cu2+ + 2OH- = Cu(OH)2↓
CuCO3 + 2NaOH = Cu(OH)2↓ + Na2CO3
B﹒CO32- + 2H+ = CO2↑ + H2O
BaCO3 + 2HCl = BaCl2 +CO2↑ + H2O
C﹒Fe+ 2H+ = H2↑ +Fe2+
Fe+ 2HNO3 = H2↑ +Fe(NO3)2
D﹒H+ + OH- = H2O
2KOH + H2SO4 = K2SO4 + 2H2O
6﹒对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是
A﹒K+ 、Na+、Cl-、NO3- B﹒Cu2+、NO3-、OH-、HCO3-
C﹒Na+、OH-、Cl-、NO3- D﹒K+ 、 Na+、 S2-、 Cl-
7﹒下列反应中,CO2作氧化剂的是
A﹒Ca(OH)2+ CO2 = CaCO3↓ + H2O
B﹒CO2 + C  2CO
2CO
C﹒2Fe2O3 +
3C  4Fe +3CO2↑
4Fe +3CO2↑
D﹒C+ 2H2O  2H2+ CO2
2H2+ CO2
8﹒地壳中含量第一和第二的两种元素所形成的化合物不具有的性质是
A﹒熔点很高 B﹒与水反应生成对应的酸
C﹒可与烧碱反应生成盐 D﹒坚硬
9﹒铜粉加入稀盐酸中,加热无现象,这时加入一种盐则铜粉溶解而溶液变蓝,同时有气体放出,这种盐是
A﹒NaCl B﹒KNO3 C﹒FeCl2 D﹒Fe2(SO4)3
10﹒固体甲与盐酸反应得到溶液乙,乙与氢氧化钠溶液反应生成沉淀丙,一段时间后,将丙加热又得到甲,则甲可能是
A﹒Fe B﹒Al C﹒FeO D﹒CuO
11﹒某溶液中,滴加KSCN溶液时无明显现象发生,再滴入少量氯水,溶液立即显红色。则原溶液中一定含有的是
A﹒Fe2+ B﹒Fe3+ C﹒K+ D﹒NH4+
12﹒用坩埚钳夹住一小块刚用盐酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝箔不滴落。下列关于上述实验中有关问题的解释不正确的是
A﹒铝箔熔化,失去金属光泽 B﹒铝在空气中能很快形成氧化膜
C﹒氧化铝的熔点比铝高 D﹒氧化铝与盐酸不反应
13﹒将预先称量的20g蔗糖放入100mL烧杯中,加几滴水搅拌均匀,再加入15mL浓硫酸,用玻璃棒迅速搅拌,观察到蔗糖由白变黑,体积膨胀,呈疏松海绵状,有刺激性气味气体生成,放出大量的热,在此过程中浓硫酸没表现出的化学性质是
A﹒吸水性 B﹒脱水性 C﹒酸性 D﹒氧化性
14﹒关于硝酸的说法正确的是
A﹒硝酸与金属反应时,主要是+5价的氮得电子
B﹒浓硝酸与浓盐酸按3︰1的体积比所配成的溶液叫王水
C﹒硝酸电离出的氢离子,内被Zn、Fe等金属还原成H2
D﹒常温下,向浓硝酸中投入Fe片,会产生大量的红棕色气体
15﹒下列选项的括号内是除去杂质所用的试剂,其中错误的是
A﹒二氧化氮中混有NO(水)
B﹒NaNO3溶液中混有Na2SO4(Ba(NO3)2)
C﹒氯气中混有水蒸气(浓硫酸)
D﹒氨气中混有水蒸气(NaOH固体)
16﹒下列两种物质中所含分子数目相同的是
A﹒2g氢气和8g氦气
B﹒常温常压下,2L氢气和2L水
C﹒常温常压下1mol氧气和标准状况下32g氧气
D﹒常温常压下,22.4L氧气和2g氢气
17﹒现有两种气体,SO2和Cl2,下列方法或试剂(必要时可加热)能用于鉴别它们的是:①观察颜色 ②石蕊试剂 ③品红溶液
A﹒只有①② B﹒只有①③ C﹒只有②③ D﹒①②③
第II卷(非选择题 共49分)
 NaCl+NH3↑+H2O
NaCl+NH3↑+H2O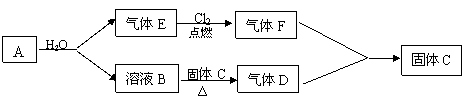
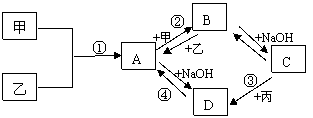 22﹒(8分)已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。
22﹒(8分)已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。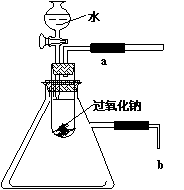 用以验证第一条结论的实验操作是
用以验证第一条结论的实验操作是