5.计算
(1)如称取硬脂酸的质量为m,配成硬脂酸的苯溶液的体积为V,那么每毫升硬脂酸的苯溶液中含硬脂酸的质量为m/V.
(2)测得每滴硬脂酸的苯溶液的体积为V1,形成单分子膜滴入硬脂酸溶液的滴数为(d-1),那么形成单分子膜需用硬脂酸的质量为:
V1(d-1)· =
=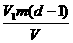
(3)根据水槽直径,计算出水槽中水的表面积S.已知每个硬脂酸分子的截面积A=2.2×10-15cm2,在水面形成的硬脂酸的分子个数为:S/A.
(4)根据(2)和(3)的结果,可计算出每个硬脂酸分子的质量为:
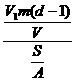 =
=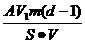
(5)1mol硬脂酸的质量等于284g(即M=284g/mol),所以1mol硬脂酸中含有硬脂酸的分子个数,即阿伏加德罗常数N为:
N=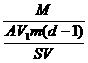 =
=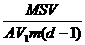
说明:计算所得N的值只要其数量级为1023均可.
[知识探究学习]
19世纪中期,某化学家为了测定元素X的摩尔质量而选择了如下的方法:他制备了含有X的四种化合物A、B、C、D,并测定了每种化合物中X的质量分数.在250℃时,四种化合物都是气态.将它们分别转移至预先抽成真空的四个等容积的烧瓶中,直到每个烧瓶内的压强达到1.013×105Pa,称每个烧瓶的质量,减去空瓶的质量后可得烧瓶内气体的质量.用氮气重复这一过程,得到如下数据表.
|
气体 |
气体的质量(g) |
气体中X元素的质量分数(%) |
|
A |
0.849 |
97.4 |
|
B |
2.398 |
68.9 |
|
C |
4.851 |
85.1 |
|
D |
3.583 |
92.2 |
|
N2 |
0.652 |
-- |
请通过计算后确定元素X的可能的摩尔质量.
答案:35.5g·mol-1
提示:只要知道1molA、B、C、D中X的质量,由其公约数,便可推知X的摩尔质量.
[生活实际运用]
在日常生活中,人们常用沼气(主要成分为甲烷CH4)和石油液化气(主要成分为丙烷C3H8)作燃料,为了使燃料充分燃烧并使能量得到充分利用,需要将燃料和空气的混合比例调整适当.现有一家庭先使用的是自制的沼气作燃料,沼气用完后改用石油液化气,那么他在使用石油液化气时对燃气灶的燃料进气阀或空气进气阀作怎样的调整?(已知CH4+2O2 CO2+2H2O,C3H8+5O2
CO2+2H2O,C3H8+5O2 3CO2+4H2O)
3CO2+4H2O)
解析:因为1molCH4完全燃烧需要2molO2,而1molC3H8完全燃烧需要5molO2,要使燃料充分燃烧,在保持燃料进气阀不变的情况下,需要将空气进气阀开大些,以使O2充足,让燃料充分燃烧;若保持空气进气阀不变,需要将燃料进气阀适当调小.

[同步达纲练习]
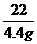 =
=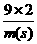 m(s)=3.6g
m(s)=3.6g