27.(1)(10分)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
①写出并配平该反应的化学方程式:
②在该反应中,得电子的物质是 ,被氧化的元素是 。
③在反应中,每转移1 mol电子,消耗HCl mol。
④下列叙述正确的是 (填写序号)。
a.在相同条件下,第VIIA族元素的阴离子的还原性从上到下逐渐增强
b.得电子越多的氧化剂,其氧化性越强
c.阳离子只能作氧化剂
d.在相同条件下,氧化性顺序:Fe3+>Cu2+>H+>Fe2+
(2)(10分)短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
|
元素编号 |
元素特征信息 |
|
A |
最高正价和最低负价的绝对值之差为2 |
|
B |
和E同主族 |
|
C |
1molC单质能与冷水反应,在标准状况下生成11.2LH2 |
|
D |
原子最外层电子数等于其周期序数 |
|
E |
负一价阴离子的电子层结构与Ar原子相同 |
①D原子结构示意图为____________;B和C形成的化合物电子式为___________;
②B和D简单离子的半径大小为__________;(用离子符号和“>”、“=”或“<”表示)
③元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是_________(填序号);
a比较两种单质的颜色 b比较氢化物的稳定性 c依据两元素在周期表的位置
d比较原子半径大小 e比较最高价氧化物对应水合物的酸性
④E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5。则该物质的结构式为___________________。
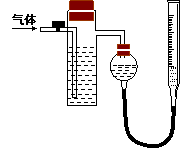 方案二:采用如右图所示装置,装置中
方案二:采用如右图所示装置,装置中
 小球做平抛运动的初速度v0 ;
小球做平抛运动的初速度v0 ;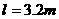 ,现将一个质量
,现将一个质量 的物体放在斜面顶端,对物体施加一个沿斜面向上的恒力F作用F=2.4N。物体从静止开始沿斜面匀加速下滑,经过时间2s,物体恰好滑至斜面底端。
的物体放在斜面顶端,对物体施加一个沿斜面向上的恒力F作用F=2.4N。物体从静止开始沿斜面匀加速下滑,经过时间2s,物体恰好滑至斜面底端。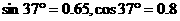 )
) 
 (14分)如图所示,水平台面AB距地面的高度h=0.80m.有一滑块从A点以v0 =6.0m/s的初速度在台面上做匀变速直线运动,滑块与平台间的动摩擦因数μ=0.25.滑块运动到平台边缘的B点后水平飞出.已知AB=2.2m。不计空气阻力,g取10m/s2,结果保留2位有效数字.求:
(14分)如图所示,水平台面AB距地面的高度h=0.80m.有一滑块从A点以v0 =6.0m/s的初速度在台面上做匀变速直线运动,滑块与平台间的动摩擦因数μ=0.25.滑块运动到平台边缘的B点后水平飞出.已知AB=2.2m。不计空气阻力,g取10m/s2,结果保留2位有效数字.求: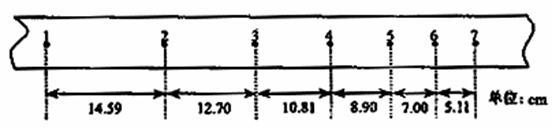

 斜面固定在水平地面上,现将一小球从斜面上P点以某一初速度水平抛出,它在空中的飞行的水平位移是X1,若将初速度大小变为原来的2倍 ,空中的飞行的水平位移是 X2,不计空气阻力,假设小球落下后不反弹,则x1和x2的大小关系可能正确的是( )
斜面固定在水平地面上,现将一小球从斜面上P点以某一初速度水平抛出,它在空中的飞行的水平位移是X1,若将初速度大小变为原来的2倍 ,空中的飞行的水平位移是 X2,不计空气阻力,假设小球落下后不反弹,则x1和x2的大小关系可能正确的是( ) 如图11所示,在一次救灾工作中,一架沿水平直线飞行的直升机A,用悬索(重力可忽略不计)救护困在湖水中的伤员B.在直升机A和伤员B以相同的水平速度匀速运动的同时,悬索将伤员吊起,在某一段时间内,A、B之间的距离以l=H-t2(式中H为直升机A离地面的高度,各物理量的单位均为国际单位制单位)规律变化,则在这段时间内( )
如图11所示,在一次救灾工作中,一架沿水平直线飞行的直升机A,用悬索(重力可忽略不计)救护困在湖水中的伤员B.在直升机A和伤员B以相同的水平速度匀速运动的同时,悬索将伤员吊起,在某一段时间内,A、B之间的距离以l=H-t2(式中H为直升机A离地面的高度,各物理量的单位均为国际单位制单位)规律变化,则在这段时间内( )