34、(16分)下面是某研究小组研究的关于不同催化剂对H2O2 分解反应的催化效率(体积在标准状况下测定)。
|
催化剂(0.1g) |
活性炭 |
FeCl3 |
KI |
MnO2颗粒状 |
MnO2粉末状 |
|
前15s产生氧气的量(ml) |
5 |
11 |
7 |
8 |
11 |
|
前30s产生氧气的量(ml) |
8 |
16 |
11 |
11 |
21 |
|
前45s产生氧气的量(ml) |
11 |
20 |
15 |
18 |
35 |
|
前60s产生氧气的量(ml) |
15 |
22.4 |
20 |
26 |
49 |
(1)写出H2O2 在催化剂作用下分解反应的化学方程式 。
(2)从上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是 。等质量的固体催化剂,颗粒大小对催化效率有什么影响 。若H2O2溶液的体积为50 mL,用H2O2表示在FeCl3的催化下,前60s的反应速率为 mol•(L•min)-1。
(3)实验发现新鲜的动物肝脏对H2O2 的分解也有显著的催化作用,但当往溶液中加入盐酸,或给溶液加热时,就会失去催化能力,合理的解释是 。
(4)对于FeCl3的催化作用,有人认为是Fe3+起催化作用,有人认为是Cl-,请你设计一个实验进行验证。 。
(5)实验需用3%H2O2溶液60mL,现用市售30%H2O2溶液(密度近似为1g/cm3)来配制,试简述具体配置方法 。
(6)下列关于催化剂的叙述正确的是
A.催化剂不参加化学反应 B.催化剂可以使原本不能发生的反应得以发生
C.催化剂只降低正反应的活化能 D.催化剂能够增大分子的百分数
33、(16分)Na2S2O3溶液跟稀 H2SO4反应的离子方程式为 。
利用此反应进行浓度或温度对反应速率影响的实验中,实验以 时开始计时,到溶液出现浑浊将锥形瓶底部的“+”字 时结束计时。
某同学进行下表中A、B、C、D四次实验:
|
|
反应温度 |
Na2S2O3 |
H2SO4 |
H2O |
||
|
℃ |
v(mL) |
L×c(mol-1) |
v(mL) |
L×c(mol-1) |
V(mL) |
|
|
A |
10 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
10 |
5 |
0.1[ |
5 |
0.1 |
10 |
|
C |
30 |
5 |
0.1 |
5 |
0.1 |
10 |
|
D |
30 |
5 |
0.2 |
5 |
0.2 |
10 |
(1)其中最先变浑浊的是 。
(2)A、B实验中分别加5 mL、10 mL水的目的是 。
(3)B与D实验 (填“能”或“否”)说明温度对反应速率的影响,原因是
。
(4)为何不用相同时间内产生SO2的量来判断浓度或温度对反应速率的影响?
。
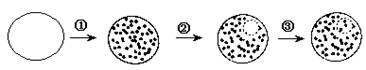
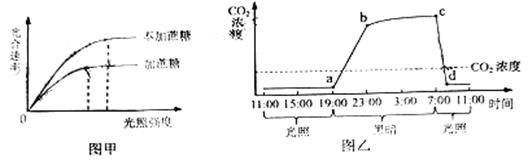 请回答:
请回答: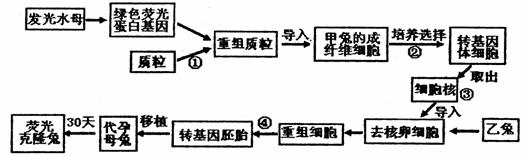 (16)日本下村修、美国沙尔菲和美籍华人钱永健因在研究绿色荧光蛋白(GFP)等方面的突出贡献,获得2008年度诺贝尔化学奖。GFP会发出绿色荧光,该蛋白质在生物工程中有着广阔的应用前景。请据图回答相关问题。
(16)日本下村修、美国沙尔菲和美籍华人钱永健因在研究绿色荧光蛋白(GFP)等方面的突出贡献,获得2008年度诺贝尔化学奖。GFP会发出绿色荧光,该蛋白质在生物工程中有着广阔的应用前景。请据图回答相关问题。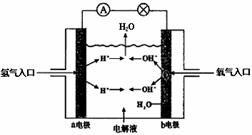 C.电池工作时,电子由正极通过外电路流向负极
C.电池工作时,电子由正极通过外电路流向负极