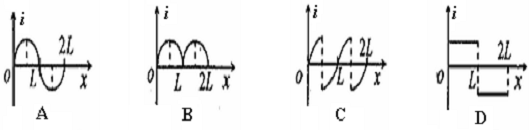29.(14分)乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:
2CO2(g) + 6H2(g)\s\up8(催化剂催化剂△CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)在一定压强和温度下,在反应物总物质的量相同的情况下,测得该反应的实验数据如下表:

|
500 |
600 |
700 |
800 |
||
|
1.5 |
45 |
33 |
20 |
12 |
||
|
2.0 |
60 |
43 |
28 |
15 |
||
|
3.0 |
83 |
62 |
37 |
22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 提高氢碳比[n(H2)/n(CO2)],则CO2的转化率___________;化学平衡____________移动,平衡常数K__________(填“增大”、“减小”、或“不变”)。
(3)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧气作用生成水和二氧化碳。该电池的负极反应式为:_____________________________________。
若以上述燃料电池为电源来电解饱和食盐水,当消耗46g乙醇时,电解产生的H2
体积(标况)为_________L。
(4)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式________________________________________________。
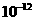 ;氢氧化铁Ksp=3.5×10-38;一水合氨电离常数K=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1)。
;氢氧化铁Ksp=3.5×10-38;一水合氨电离常数K=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1)。
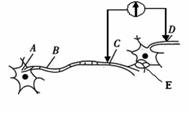 (16分)回答下列有关生物生命活动调节的相关问题:
(16分)回答下列有关生物生命活动调节的相关问题: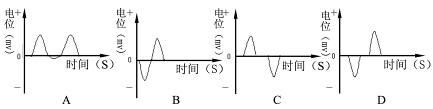
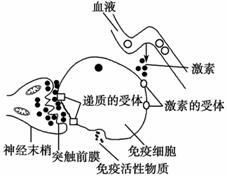 (3)科学研究表明:精神因素(焦虑、紧张等的心理应激)会使T细胞活性下降,对病毒、真菌感染的抵抗能力和对肿瘤细胞的监控能力下降,还间接引起机体生成抗体的能力降低。下图表示神经、免疫、内分泌三大系统相互调节的部分示意图,请据图回答:
(3)科学研究表明:精神因素(焦虑、紧张等的心理应激)会使T细胞活性下降,对病毒、真菌感染的抵抗能力和对肿瘤细胞的监控能力下降,还间接引起机体生成抗体的能力降低。下图表示神经、免疫、内分泌三大系统相互调节的部分示意图,请据图回答: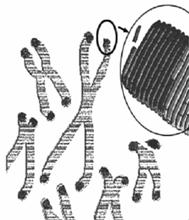 Ⅰ.2009年诺贝尔生理学或医学奖授予因发现端粒和端粒酶如何保护染色体的三位学者。端粒(右图中染色体两端所示)通常是由富含鸟嘌呤核苷酸(G)的短的串联重复序列组成。它们能防止不同染色体末端发生错误融合。但是,细胞每分裂一次,端粒就会丢失一部分;在细胞衰老过程中端粒逐渐变小。端粒酶可利用某段RNA序列作为模板合成端粒DNA,对端粒有延伸作用。
Ⅰ.2009年诺贝尔生理学或医学奖授予因发现端粒和端粒酶如何保护染色体的三位学者。端粒(右图中染色体两端所示)通常是由富含鸟嘌呤核苷酸(G)的短的串联重复序列组成。它们能防止不同染色体末端发生错误融合。但是,细胞每分裂一次,端粒就会丢失一部分;在细胞衰老过程中端粒逐渐变小。端粒酶可利用某段RNA序列作为模板合成端粒DNA,对端粒有延伸作用。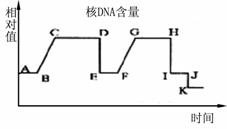
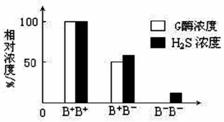 度和H2S浓度的关系。据图描述B+ B+ 和B+ B-个体的基因型、G酶浓度与H2S浓度之间的关系:__________________________________________。B- B-个体的血浆中没有G酶而仍有少量H2S产生,可能的原因是___________________。
度和H2S浓度的关系。据图描述B+ B+ 和B+ B-个体的基因型、G酶浓度与H2S浓度之间的关系:__________________________________________。B- B-个体的血浆中没有G酶而仍有少量H2S产生,可能的原因是___________________。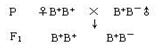 (4)以该B+ B- 雄性小鼠与正常小鼠(B+ B+ )为亲本,进行杂交育种,选育B- B- 雌性小鼠。请将育种过程补充完整。
(4)以该B+ B- 雄性小鼠与正常小鼠(B+ B+ )为亲本,进行杂交育种,选育B- B- 雌性小鼠。请将育种过程补充完整。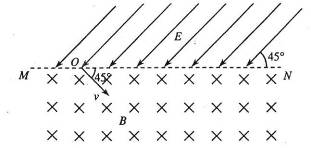 (1) 画出粒子在磁场和电场中运动轨迹的草图;
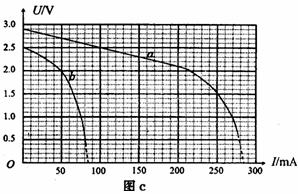
(1) 画出粒子在磁场和电场中运动轨迹的草图;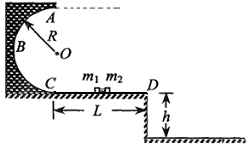
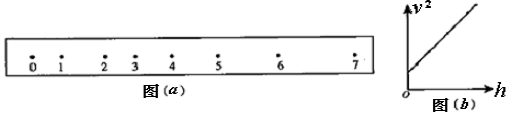 ①该同学求6号点速度的计算式是:v6=
①该同学求6号点速度的计算式是:v6=
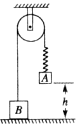 A.物体A的加速度大小为g,方向竖直向下
A.物体A的加速度大小为g,方向竖直向下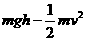
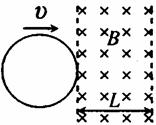 如图所示,两平行虚线之间存在的匀强磁场,磁场方向垂直纸面向里,虚线间的距离为L,金属圆环的直径也是L.圆环以垂直于磁场边界的恒定速度v穿过磁场区域.规定逆时针方向为圆环中感应电流i的正方向,圆环从左边界刚进入磁场处为位移x的起点.则下列图象中能表示圆环中感应电流i随其位移x变化关系的是
如图所示,两平行虚线之间存在的匀强磁场,磁场方向垂直纸面向里,虚线间的距离为L,金属圆环的直径也是L.圆环以垂直于磁场边界的恒定速度v穿过磁场区域.规定逆时针方向为圆环中感应电流i的正方向,圆环从左边界刚进入磁场处为位移x的起点.则下列图象中能表示圆环中感应电流i随其位移x变化关系的是