35. [化学-选修物质结构与性质](15分)
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
 单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
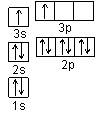
(1)某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 。
(2)根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。
 (4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,
其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的电子排布式
,该物质的K原子和C60分子的个数比为 。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,
其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的电子排布式
,该物质的K原子和C60分子的个数比为 。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
28.(14分)“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1) 其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) == C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) == C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为 。
 (2)在一定条件下,6H2(g) +2CO2(g)
(2)在一定条件下,6H2(g) +2CO2(g)  CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
|
CO2转化率(%) n(H2)/n(CO2) |
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2 |
60 |
43 |
28 |
15 |
|
3 |
83 |
62 |
37 |
22 |
根据上表中数据分析:
① 温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率 (填“增大”“减小”“不变”)。
② 该反应的正反应为 (填“吸”或“放”)热反应。
(3)一定条件下,将3molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+
CO2(g) CH3OH(g)+ H2O(g)。2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L。下列判断不正确的是
。
CH3OH(g)+ H2O(g)。2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L。下列判断不正确的是
。
a. 该条件下此反应的化学平衡常数表达式为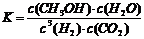
 b. H2的平均反应速率为0.3mol/(L·s)
b. H2的平均反应速率为0.3mol/(L·s)
c. CO2的转化率为60%
d. 若混合气体的密度不再改变时,该反应一定达到平衡状态
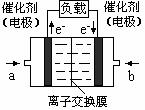
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是 (填“乙醇”或“氧气”),b处电极上发生的电极反应是: 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为大于 。
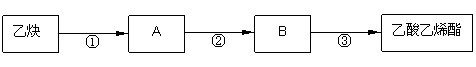 只用乙炔为有机原料合成乙酸乙烯酯(CH3COOCH=CH2),合成路线如下:
只用乙炔为有机原料合成乙酸乙烯酯(CH3COOCH=CH2),合成路线如下: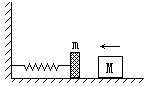 (1)(5分)、如图所示,轻弹簧一端固定在墙上,另一端连一挡板,挡板的质量为m,一物体沿光滑水平面以一定的速度撞向挡板,物体质量为M,物体与挡板相接触的一面都装有尼龙搭扣,
使得它们相撞后立即粘连在一起,若碰撞时间极短(即极短时间内完成粘连过程),则对物体M、挡板m和弹簧组成的系统,下面说法中正确的是:
(1)(5分)、如图所示,轻弹簧一端固定在墙上,另一端连一挡板,挡板的质量为m,一物体沿光滑水平面以一定的速度撞向挡板,物体质量为M,物体与挡板相接触的一面都装有尼龙搭扣,
使得它们相撞后立即粘连在一起,若碰撞时间极短(即极短时间内完成粘连过程),则对物体M、挡板m和弹簧组成的系统,下面说法中正确的是: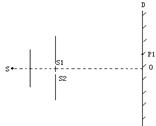 (1)(5分)、如图为杨氏双缝干涉实验示意图,其中S1、S2为双缝,D为光屏,实验中观察到屏上O点为中央亮纹的中心,P1为第一级亮纹的中心。在其它条件不变的情况下,若将D屏向右平移一段距离,则
(1)(5分)、如图为杨氏双缝干涉实验示意图,其中S1、S2为双缝,D为光屏,实验中观察到屏上O点为中央亮纹的中心,P1为第一级亮纹的中心。在其它条件不变的情况下,若将D屏向右平移一段距离,则
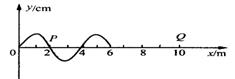 ①Q点第一次出现波峰时间
①Q点第一次出现波峰时间
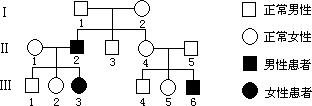 (10分)下图为人类中的一种单基因遗传病系谱图。请回答:
(10分)下图为人类中的一种单基因遗传病系谱图。请回答:
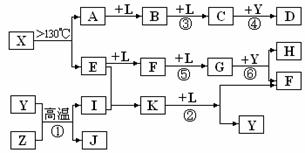
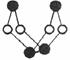 (14分)已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁, D、H、K均是重要的化工产品;X分子的球棍模型如图所示,组成X的两种元素的相对原子质量相差18。下列框图中部分反应条件已略去。
(14分)已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁, D、H、K均是重要的化工产品;X分子的球棍模型如图所示,组成X的两种元素的相对原子质量相差18。下列框图中部分反应条件已略去。