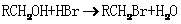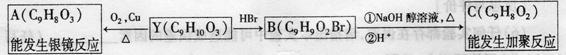30.[化学-物质结构与性质](13分) K^S*5U.C
W、X、Y、Z4种元素原子序数依次减小。W的原子序数为24;X原子p轨道共有11个电子;Y是第三周期主族元素,其部分电离能(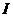 )如下表;Z原子价电子排布式为
)如下表;Z原子价电子排布式为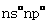 。请回答下列问题:
。请回答下列问题:
|
电离能/KJ·mol·L-1 |
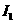 |
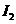 |
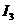 |
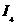 |
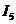 |
|
Y |
584 |
1823 |
2751 |
11584 |
14837 |
(1)W基态原子的电子排步式为 。
(2)点负性:X Y(填“>”、“=”或“<”)。
(3)R是与X同主族的短周期元素。R的氢化物沸点比X的氢化物更高,原因是:
。
(4)氨为常见化工原料,氨分子中N原子采用 杂化,该分子的空间构型为
,分子中N、H原子之间形成
(填“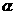 ”或“
”或“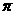 ”)键;已知
”)键;已知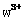 能与氨分子形成配离子
能与氨分子形成配离子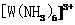 ,该配离子中存在的化学键有 。(填标号)
,该配离子中存在的化学键有 。(填标号)
A.金属键 B.离子键 C.共价键 D.配位键
26.(25分)回答下列Ⅰ、Ⅱ题:
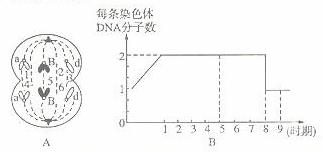
Ⅰ.(10分)右下图表示生物体内部分代谢过程中氢的转移途径。请据图回答下列问题:
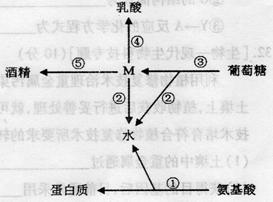 (1)通过①过程形成水的场所是
(1)通过①过程形成水的场所是
(细胞器)。
(2)图中的M最可能代表的物质是
。
(3)在人体细胞内不可能发生的途经是图 K^S*5U.C
中的 (填序号);人体细胞通
常分解葡萄糖的总反应式为
,其
途径为图中的 (填序号)。
Ⅱ.(15分)科学家研究发现,光线对莴苣种子萌发的影响与光的波长有关,波长为660nm的红光促进莴苣种子萌发效果最显著,波长为730nm的远红光抑制莴苣种子萌发效果最显著。有人用波长为660nm的红光(R)和波长为730nm的远红光(FR)交替照射莴苣种子,且每次照射后取出一部分种子放在暗处发芽,并对种子萌发率进行统计,结果如下表:
|
光处理方式 |
萌发率(%) |
|
R |
92 |
|
R-FR |
6 |
|
R-FR-R |
94 |
|
R-FR-R-FR |
5 |
|
R-FR-R-FR-R |
93 |
|
R-FR-R-FR-R-FR |
6 |
请回答下列问题:
(1)光的波长在生态系统中是 信息。
(2)上述实验中,要控制好的无关变量有 (至少回答两点)。
(3)从交替照射实验的数据表可以得出,莴苣种子的萌发率大小,与
有关。
(4)有同学通过查找资料发现,赤霉素能解除远红光对莴苣种子萌发的抑制,提高莴苣种子的萌发率。现提供能产生红光和远红光的光源,足够的莴苣种子,适宜浓度的赤霉素,暗箱等材料用具。请设计实验验证赤霉素能提高莴苣种子的萌发率。
实验步骤:
A.在暗箱中,应选择 光源照射莴苣种子。
B.将照射过的种子在暗箱中均分为两组并编号,一组不做处理,另一组用 进行处理。
C.继续置暗箱中,在适宜条件下培养,一段时间后,观察记录萌发情况。 K^S*5U.C
实验结果:
若 ,说明赤霉素能解除远红光对莴苣种子萌发的抑制,提高莴苣种子的萌发率。
25.(16分)
铜及其化合物在生产和生活实际中应用广泛。
Ⅰ.某学习小组对粗铜提纯后的阳极泥(主要成分为银、金)进行如下实验。

(1)操作③所需的仪器有:烧杯、 。
(2)为了回收金,他们查阅了有关资料如下表: K^S*5U.C
|
编号 |
常温下反应 |
化学平衡常数 |
|
反应1 |
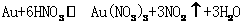 |
< |
|
反应2 |
 |
>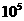 |
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸按体积比1:3的混合物)。请你运用化学平衡移动原理,简要说明金能溶于王水的原因: 。 K^S*5U.C
Ⅱ.学习小组对无水硫酸铜分解的产物进行实验探究。
[提出问题]碳酸钙受热分解生成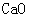 和
和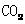 ,那么无水碳酸铜受热分解也只生成
,那么无水碳酸铜受热分解也只生成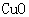 和
和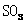 吗?
吗?
[设计实验]按下图装置进行试验。
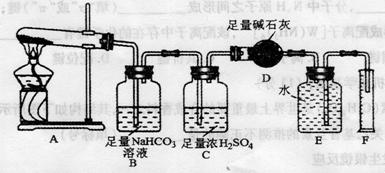
[实验过程]a.准确称取无水硫酸铜2.40g于装置A试管中加热,直至固体全部变为黑色,经验证该黑色粉末为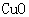
b.实验中,观察到装置E中的水部分被排入量筒中;实验结束后,测得量筒中水的体积为112 mL(已折算成标准状态下气体的体积),并测得干燥管D的质量增加了1.32g。
(3)装置C的作用 。
(4)根据装置E、F中现象,推测还有气体
(填分子式)生成;实验生成的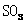 为
mol。
为
mol。
(5)装置A中反应的化学方程式为 。
[实验结论]无水硫酸铜受热分解不仅仅生成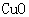 和
和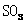 。
。
[反思与评价]
(6)任何实验都存在误差,请指出本实验中可能造成误差的因素 。(任写2点)
24.(14分)
随着环保意识增强,清洁能源越来越受到人们关注。
(1)甲烷是一种理想的洁净燃料。已知:
CH4(g)+2O2(g) = CO2(g)+2H2O(g) 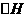 =-802.3kJ·mol-1
=-802.3kJ·mol-1
H2O(1) = H2O(g) 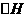 =+44.0kJ·mol-1
=+44.0kJ·mol-1
则4.8g甲烷气体完全按燃烧生成液态水,放出热量为 。
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。
该反应为CH4(g)+ H2O(g)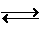 CO(g)+3H2(g)
CO(g)+3H2(g) 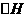 =+206.1kJ·mol-1。
=+206.1kJ·mol-1。
①若800CC时,反应的化学平衡常数K=l.O,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
|
CH4 |
H2O |
CO |
H2 |
|
3.0mol·L-1 |
8.5mol·L-1 |
2.0mol·L-1 |
2.0mol·L-1 |
则此时正、逆反应速率的关系是 。(填标号)
A.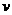 (正)>
(正)>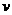 (逆) B.
(逆) B.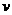 (正)<
(正)<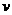 (逆)
(逆)
C.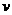 (正)=
(正)=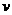 (逆) D.无法判断
(逆) D.无法判断
②为了探究温度、压强对上述化学反应速率的影响,张山同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
|
实验序号 |
温度/℃ |
压强/kPa |
CH4初始浓度/ mol·L-1 |
H2O初始浓度/ mol·L-1 |
|
1 |
360 |
P |
2.00 |
6.80 |
|
2 |
t |
101 |
2.00 |
6.80 |
|
3 |
360 |
101 |
2.00 |
6.80 |
表中t= ,P= ;
设计实验2、3的目的是 ;
实验l、2、3中反应的化学平衡常数的大小关系是 (用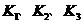 表示)。
表示)。
(3)利用作催化剂,通过两步反应可将水分解制得氢气,第一步反应为:
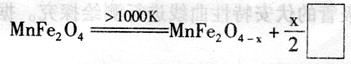
则框内物质为 ;第二步反应的化学方程式为 (可不写反应条件)。
 A.
“风云一号”比“风云二号”的发射速度大
B. “风云一号”比“风云二号”的线速度小
C. “风云一号”比“风云二号”的运动周期小
D. “风云一号”比“风云二号”的向心加速度小
A.
“风云一号”比“风云二号”的发射速度大
B. “风云一号”比“风云二号”的线速度小
C. “风云一号”比“风云二号”的运动周期小
D. “风云一号”比“风云二号”的向心加速度小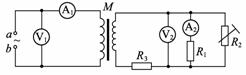 A. A1的示数不变,A2的示数增大
A. A1的示数不变,A2的示数增大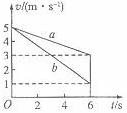 D. A1的示数增大,A2的示数增大
D. A1的示数增大,A2的示数增大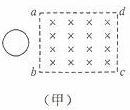 C.物体的摩擦力可能等于0.1N
C.物体的摩擦力可能等于0.1N 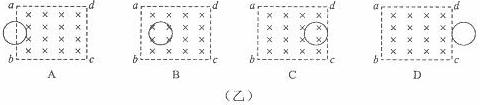
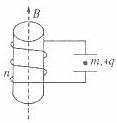 如图所示,两块水平放置的金属板距离为d,用导线与一个n匝的线圈连接,线圈置于方向竖直向上的磁场B中。两板间有一个质量为m、电量为+q的油滴恰好处于平衡状态,则线圈中的磁场B的变化情况和磁通量变化率分别是 (
)
如图所示,两块水平放置的金属板距离为d,用导线与一个n匝的线圈连接,线圈置于方向竖直向上的磁场B中。两板间有一个质量为m、电量为+q的油滴恰好处于平衡状态,则线圈中的磁场B的变化情况和磁通量变化率分别是 (
)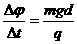 B.正在减弱,
B.正在减弱,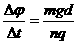
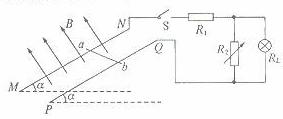
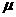 =0.1 (g
取10
m/s2)
=0.1 (g
取10
m/s2) (1)若两皮带轮之间的距离是6m,物体冲上传送带后就移走光滑曲而,物体将从哪一边离开传送带?通过计算说明你的结论.
(2)若皮带轮间的距离足够大,从物体滑上到离开传送带的整个过程中,由于物体和传送带间的摩擦而产生了多少热量?
26. ( 19 分)提高光合速率可以提高农作物的产量,光合作用过程需要许多酶的催化作用,科学家通过对有关酶及相关基因的研究,在野生植物体内找到了影响光合速率的主要基因并进行了相关实验,得到了某种转基因作物。某中学生物兴趣小组在暑假开展了对该转基因作物光合强率测试的研究课题,设汁了如下装置。请你分析并回答下列有关问题。
(1)若两皮带轮之间的距离是6m,物体冲上传送带后就移走光滑曲而,物体将从哪一边离开传送带?通过计算说明你的结论.
(2)若皮带轮间的距离足够大,从物体滑上到离开传送带的整个过程中,由于物体和传送带间的摩擦而产生了多少热量?
26. ( 19 分)提高光合速率可以提高农作物的产量,光合作用过程需要许多酶的催化作用,科学家通过对有关酶及相关基因的研究,在野生植物体内找到了影响光合速率的主要基因并进行了相关实验,得到了某种转基因作物。某中学生物兴趣小组在暑假开展了对该转基因作物光合强率测试的研究课题,设汁了如下装置。请你分析并回答下列有关问题。
 NH3 ( g ) + HI ( g
) ② 2 HI ( g )
NH3 ( g ) + HI ( g
) ② 2 HI ( g ) 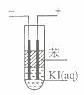 (3)如图,在粗试管中加人饱和的KI
溶液,然后再加人苯,插人两根石墨电极,接通直流电源。连接电源负极的电极为
极,电极反应式为
.通电一段时间后,断开电源,振荡试管,上层溶液为
色.
(3)如图,在粗试管中加人饱和的KI
溶液,然后再加人苯,插人两根石墨电极,接通直流电源。连接电源负极的电极为
极,电极反应式为
.通电一段时间后,断开电源,振荡试管,上层溶液为
色.
 (3)I的溶液呈(填“酸性”、 “中性”或“碱性”),原因是(用离子反应方程式表示)
。用化学符号表示I的水溶液中各粒子的浓度关系
.
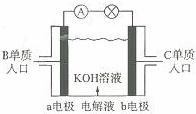
(4)B、C
单质已被应用于宇宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电。b是电池的 极;a电极上的电极反应式是
(3)I的溶液呈(填“酸性”、 “中性”或“碱性”),原因是(用离子反应方程式表示)
。用化学符号表示I的水溶液中各粒子的浓度关系
.
(4)B、C
单质已被应用于宇宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电。b是电池的 极;a电极上的电极反应式是
 检测目的基因是否成功导入植物细胞,可采用的生物技术是 。
检测目的基因是否成功导入植物细胞,可采用的生物技术是 。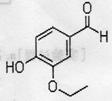 (1)以下有关乙基香兰素的推测不正确的是
。(填标号)
(1)以下有关乙基香兰素的推测不正确的是
。(填标号)