26.(25分)回答下列Ⅰ、Ⅱ题:
Ⅰ、(15分)某学习小组用黑藻进行光合作用实验,他们将黑藻浸在加有适宜培养液的6大试管中(室温20℃),可观察到光下黑藻放出气泡。他们以日光灯作光源,移动日光灯使之与大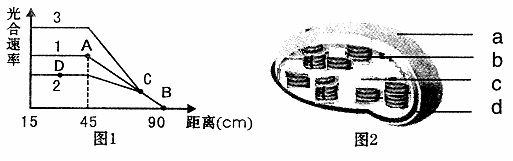 试管的距离不同,结果如图1中曲线1,请回答:
试管的距离不同,结果如图1中曲线1,请回答:
(1)该实验研究的是 (因素)对光合速率的影响,衡量光合速率的指标是 。
(2)该小组在室温10℃和30℃时分别进行了实验,结果如曲线2和3,D点的限制因素是 。
(3)该小组分离出黑藻中的叶绿体(图2为模式图)在适宜条件下培养,在b上发生的能量转换为 ,由b转移至C的物质主要是 。
|
温度(℃) |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
|
光照下吸收CO2(mg/h) |
1.00 |
1.75 |
2.50 |
3.15 |
3.75 |
3.53 |
3.00 |
|
黑暗中释放CO2(mg/h) |
0.50 |
0.75 |
1.25 |
1.75 |
2.25 |
3.00 |
3.50 |
(4)将黑藻放在特定实验装置内,研究温度对光合作用与呼吸作用的影响(其余的实验条件都是理想的),实验以CO2的吸收量与释放量为指标。实验结果如下表所示:
①在一定范围内该绿色植物呼吸速率随温度升高而升高,其原因是 。
②若在昼夜不停的光照下,则该植物生长的最适宜温度是 ,在35℃时,该植物每小时实际光合作用速率为 。(用CO2吸收量表示)
Ⅱ.(10分)下图为人体血糖平衡调节示意图。请据图回答有关问题:
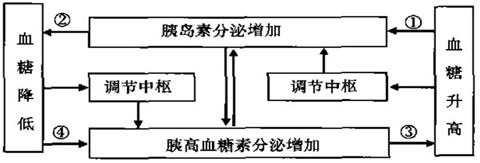
(1)正常情况下人体血糖降低的主要原因是 。
(2)图示中的调节中枢是 ,胰高血糖素的受体细胞主要是 细胞。
(3)从图示可以看出胰高血糖素与胰岛素在调节血糖平衡上具有拮抗作用,除此之外, 胰高血糖素与肾上腺分泌的 在调节血糖平衡上具有协同作用。
(4)胰高血糖素分泌增加会直接 胰岛素的分泌。
24.(13分)工业合成氨与制备硝酸一般可连续生产,流程如下:
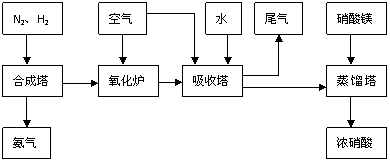

(1)工业生产时,制取氢气的一个反应为:CO+H2O CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K= 。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)= 。
(2)合成塔中发生反应为:N2(g)+3H2(g)
 2NH3(g);△H<0。右表为不同温度下该反应的平衡常数。由此可推知,表中T1
573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。右表为不同温度下该反应的平衡常数。由此可推知,表中T1
573K(填“>”、“<”或“=”)。
|
T/K |
T1 |
573 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
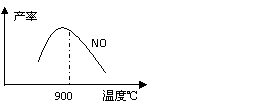 4NH3+5O2
4NH3+5O2 4NO+6H2O △H=-905kJ·mol-1 不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的原因是
。
4NO+6H2O △H=-905kJ·mol-1 不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的原因是
。
(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
。
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_______ __________________。
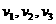 的三种光,且
的三种光,且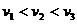 则该照射光的光子能量为 (填选项前的编号)
则该照射光的光子能量为 (填选项前的编号)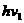 ②
②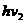 ③
③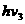 ④
④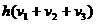
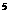
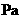 ,刚通电时显示温度为27℃,通电一段时间后显示温度为6℃,则此时冷藏室中气体的压强是______。(填选项前的编号)
,刚通电时显示温度为27℃,通电一段时间后显示温度为6℃,则此时冷藏室中气体的压强是______。(填选项前的编号)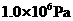 ②
②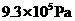 ③
③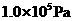 ④
④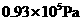
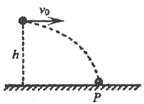 (19分)个质量为m带电量为+q的小球以水平初速度v0自离地面h高度处做平抛运动.不计空气阻力,开始时空间没有任何的电场或磁场,重力加速度为g,求:
(19分)个质量为m带电量为+q的小球以水平初速度v0自离地面h高度处做平抛运动.不计空气阻力,开始时空间没有任何的电场或磁场,重力加速度为g,求: