28.(16分)
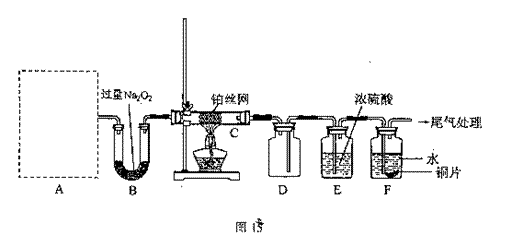
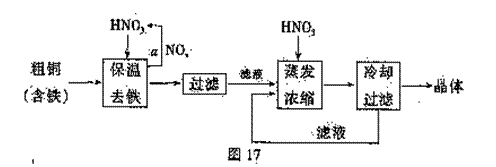 (1)工业上以粗铜为原料采取如图17所示流程制备硝酸铜晶体。
(1)工业上以粗铜为原料采取如图17所示流程制备硝酸铜晶体。
①步骤a中,还需要通入氧气和水,其目的是 。
②根据下表数据,在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
|
|
氢氧化开始沉淀时pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的主要原因是 。
 ③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其原因是(结合离子方程式说明)
。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其原因是(结合离子方程式说明)
。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时
阴极反应式是 。
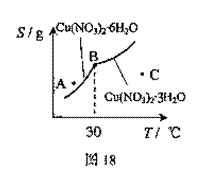
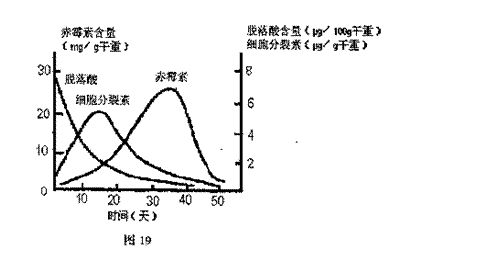
(3)图18是某小组同学查阅资料所绘出的硝酸
铜晶体[Cu(NO3)2·nH2O]的溶解度曲线
(温度在30℃前后对应不同的晶体),下
列说法正确的是 (填字母)。
a.A点时溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程终得到晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
;Cu与液态N2O4反应制得无水硝酸的化学方程式是
。
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
;Cu与液态N2O4反应制得无水硝酸的化学方程式是
。
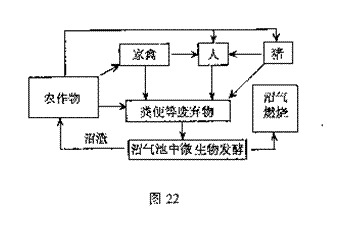 (18分)图22是某生态农业的结构模式图,请据图分析回答:
(18分)图22是某生态农业的结构模式图,请据图分析回答: 来自农作物,
来自农作物,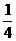 来自家禽,
来自家禽,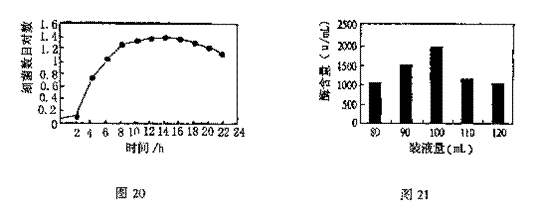
 a.NH4HCO3 b.NH4C1 c.Ca(OH)2 d.NaOH
a.NH4HCO3 b.NH4C1 c.Ca(OH)2 d.NaOH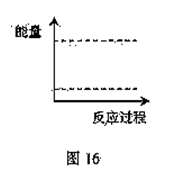 (4)请在图16坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(4)请在图16坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。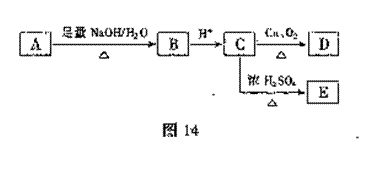 A在一定条件下有如图14所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
A在一定条件下有如图14所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。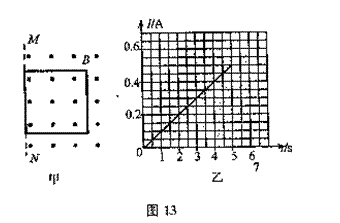 (3)已知在这5s内力F做功1.92J,那么在此过程中,线框产生的焦耳热是多少?
(3)已知在这5s内力F做功1.92J,那么在此过程中,线框产生的焦耳热是多少?
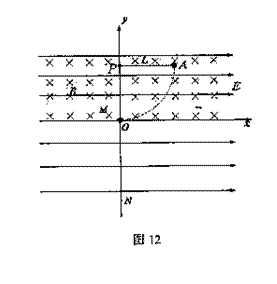 (1)小球运动到O点时的速度大小;
(1)小球运动到O点时的速度大小;