28.(9分)硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。
某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
提出问题:Na2S2O3是否与Na2SO4具备相似的下列性质呢?
猜想①: ;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
实验探究:基于上述猜想②、③,设计实验方案。
|
|
实验操作 |
实验现象或 预期实验现象 |
现象解释(用离子 方程式表示) |
|
猜想② |
|
溶液pH=8 |
- |
|
向pH=2的硫酸中滴加Na2S2O3溶液 |
|
S2O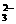 +2H+=== +2H+===S↓+SO2↑+H2O |
|
|
猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
|
实验结果:Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
问题讨论:
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由 。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是
。
 写出Na2S2O3被Cl2氧化的离子反应方程式: 。
写出Na2S2O3被Cl2氧化的离子反应方程式: 。
 ② C4沸点比P4(白磷)低
② C4沸点比P4(白磷)低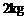 的物块A(可看作质点),开始放在长木板B的左端,B的质量为m=
的物块A(可看作质点),开始放在长木板B的左端,B的质量为m=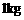 ,长木板B可在水平面上无摩擦滑动。两端各有一固定竖直挡板M、N,现A、B以相同速度
,长木板B可在水平面上无摩擦滑动。两端各有一固定竖直挡板M、N,现A、B以相同速度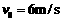 向左运动并与挡板M发生碰撞。B与M碰后速度立即变为0,但不与M粘结; A与M碰后没有机械能损失,碰后接着返回向N板运动,且在与N板碰撞之前,A、B能达共同速度.在长木板B即将与档板N碰前,立即将A锁定于长木板B上,使长木板B与档板N碰后,A、B一并原速反向. B与档板N碰后,立即解除对A的锁定(锁定和解除锁定过程均无机械能损失)。以后A、B若与M、N档板碰撞,其过程同前。A、B之间动摩擦因数
向左运动并与挡板M发生碰撞。B与M碰后速度立即变为0,但不与M粘结; A与M碰后没有机械能损失,碰后接着返回向N板运动,且在与N板碰撞之前,A、B能达共同速度.在长木板B即将与档板N碰前,立即将A锁定于长木板B上,使长木板B与档板N碰后,A、B一并原速反向. B与档板N碰后,立即解除对A的锁定(锁定和解除锁定过程均无机械能损失)。以后A、B若与M、N档板碰撞,其过程同前。A、B之间动摩擦因数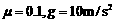 。求:
。求: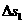 是多少?
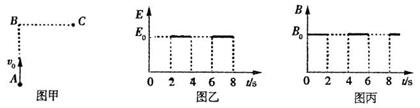
是多少?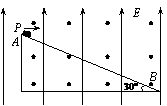 (18分)如图所示,在足够大的空间范围内,同时存在着竖直向上的匀强电场和垂直
(18分)如图所示,在足够大的空间范围内,同时存在着竖直向上的匀强电场和垂直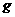 ,求:
,求: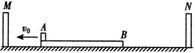 (2)物体P在斜面顶端受到瞬时冲量后所获得的初速度的大小。
(2)物体P在斜面顶端受到瞬时冲量后所获得的初速度的大小。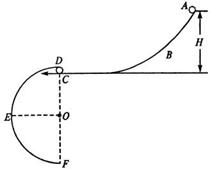 (14分)如图所示,ABC和DEF是在同一竖直平
(14分)如图所示,ABC和DEF是在同一竖直平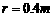 的半圆形轨道,其直径DF沿竖直方向,C、D可看作重合。现有一视为质点的小球从轨道ABC上距C点高为H的位置由静止释放。
的半圆形轨道,其直径DF沿竖直方向,C、D可看作重合。现有一视为质点的小球从轨道ABC上距C点高为H的位置由静止释放。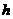 小于(1)中H的最小值,小球可击中与圆心等高的E点,求
小于(1)中H的最小值,小球可击中与圆心等高的E点,求 )
)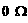 ”附近,为减小测量误差,应换倍率更大的档测量
”附近,为减小测量误差,应换倍率更大的档测量 )
)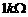 )
) (量程
(量程 ,内阻在
,内阻在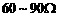 之间)
之间)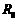 (
( ,允许的最大电流为
,允许的最大电流为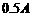 )
)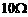 ,允许的最大电流为1A)
,允许的最大电流为1A) ②该同学测出的电流表的内阻
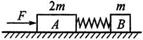
②该同学测出的电流表的内阻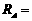
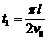
 如图所示,物块B的质量为
如图所示,物块B的质量为 ,与地面的动摩擦因数为
,与地面的动摩擦因数为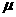 ;A质量为
;A质量为 ,与地面间的摩擦不计。A、B间固定一轻弹簧,在水平推力F的作用下,A、B一起做匀加速直线运动,则
,与地面间的摩擦不计。A、B间固定一轻弹簧,在水平推力F的作用下,A、B一起做匀加速直线运动,则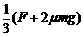
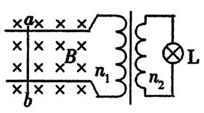 如图所示,两平行光滑金属导轨处于水平面内,相距
如图所示,两平行光滑金属导轨处于水平面内,相距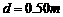 ,磁感应强度
,磁感应强度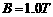 的匀强磁场垂直于导轨平面竖直向下,金属棒
的匀强磁场垂直于导轨平面竖直向下,金属棒 垂直于导轨放置,并与导轨始终保持良好接触。导轨的右端用导线与一理想变压器的原线圈相连,变压器的副线圈两端接有一个“10V 2.0W”的小灯泡L。现用外力使金属棒ab沿导轨左右运动,金属棒ab速度的变化规律为
垂直于导轨放置,并与导轨始终保持良好接触。导轨的右端用导线与一理想变压器的原线圈相连,变压器的副线圈两端接有一个“10V 2.0W”的小灯泡L。现用外力使金属棒ab沿导轨左右运动,金属棒ab速度的变化规律为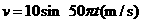 ,此时小灯泡恰好正常发光。不计导轨、导线及金属棒的电阻,下列说法正确的是
,此时小灯泡恰好正常发光。不计导轨、导线及金属棒的电阻,下列说法正确的是