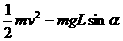5.在两个相同的密闭.透明玻璃室内各放置一盆长势相似的甲.乙两种植物幼苗,在充足的水分.光照和适宜的温度等条件下,用红外线测量仪定时测量玻璃室内的CO2含量,结果如下表(假设实验期间光照.水分和温度等条件恒定不变)。下列有关分析,错误的是
|
记录时间(min) |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
甲种植物(mg/L) |
150 |
113 |
83 |
58 |
50 |
48 |
48 |
48 |
48 |
48 |
|
乙种植物(mg/L) |
150 |
110 |
75 |
50 |
30 |
18 |
8 |
8 |
8 |
8 |
A.在0 - 25min期间,影响光合速率的主要因素是CO2浓度
B.上表数据说明,甲植物比乙植物固定CO2的能力强
C.在0 - 25min期间,甲和乙两种植物光合速率都逐渐减小
D.在30 - 45min期间,甲.乙两种植物仍然在进行光合作用
30.(24分)回答下列I、II小题:
I.(10分)近期研究表明,我们面对新信息时大脑中需要建立起一个新的处理路径。此时,被新信息激活的神经元会生长出新的突起,一直延伸到邻近的神经元,形成突触。突触一旦形成,兴奋就可以从一个神经元传到另外一个神经元,我们也就获得了新的信息。若建立起的突触失灵了,大脑就忘记了这个信息。
(1)大脑在初次学习时需要的时间比再次学习时需要的时间长,原因是再次学习时不需要______________________;而随年龄的增长,神经元衰老,获得新信息需要的时间更长,是由于_______________________。
(2)突触形成后,兴奋在神经纤维上的传导是___________(单向/双向)。
(3)有关研究表明,人在安静时大脑的产热量是运动时的6倍,则人在_________时更容易记忆,原因是在该情况下脑细胞__________________强。
II.(14分)某池塘的水层由上至下分别为表水层、斜温层、静水层和底泥层,在冬夏两季分别对该池塘的温度和氧气进行垂直结构分析,统计数据如下表:
|
水 层 |
表水层 |
斜温层 |
静水层 |
底泥层 |
|
|
温度(℃) |
夏 |
25 |
14 |
8 |
4 |
|
冬 |
2 |
3.8 |
4 |
4 |
|
|
O2(μL·L-1) |
夏 |
9.5 |
6.2 |
3.4 |
0.2 |
|
冬 |
12 |
11.8 |
10.6 |
10.2 |
(1)从表中数据分析,夏季池塘中随着水深的增加,O2含量下降,引起这种现象的非生物因素主要是________________________;夏季各水层的O2含量低于冬季,其生物学原因是_____________________________________________________________________。
(2)夏季底泥层和表水层相比,O2含量非常低的原因是_______________________________
____________________________________________________。
(3)某同学为了测定斜温层水样的总光合作用生产量,先测出该水层的原始溶氧量,再取两个无色透明玻璃瓶A、B,其中A瓶先包上黑胶布,再包以锡箔,B瓶不包裹。在A、B两瓶内装入等量水样,密封后沉入水中一定深度,24小时后取出测定。
①在实验中,A、B两瓶密封后沉入水中“一定深度”,此深度指______________深度。
②A瓶中所测得的数据可以得知正常的____________________量(设为a),B瓶中含氧量的变化可以确定____________________量(设为b),则利用A、B两瓶的测量数据就可以计算出光合作用生产量为____________________。
22.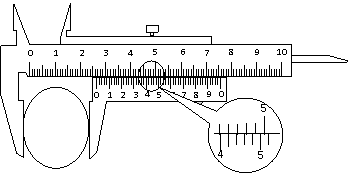 (17分)I (4分)用螺旋测微器测量一根电阻丝的直径,测量结果如图,其读数为 _ ___mm。用游标为50分度的卡尺测量一工件的直径,测量结果如图所示,此工件的直径为________cm。
(17分)I (4分)用螺旋测微器测量一根电阻丝的直径,测量结果如图,其读数为 _ ___mm。用游标为50分度的卡尺测量一工件的直径,测量结果如图所示,此工件的直径为________cm。
 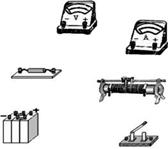 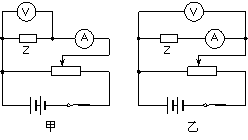
丙 (3)在图丙中将所选器材,用笔画线代表导线进行实物连线; 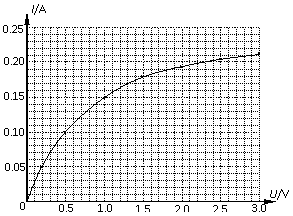 (4)利用这些数据绘出的用电器Z的伏安特性曲线
如图所示,请根据这些数据和图线解决下列问题: (4)利用这些数据绘出的用电器Z的伏安特性曲线
如图所示,请根据这些数据和图线解决下列问题: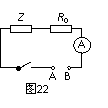 ①分析曲线可知小灯泡的电阻随U变大而
(填“变大”、“变小”或“不变” ); ①分析曲线可知小灯泡的电阻随U变大而
(填“变大”、“变小”或“不变” );②若把用电器Z接入如图所示的 电路中时,电流表的读数为0.100A,已知A、B两端电压恒为1.5V,则定值电阻R0阻值为________Ω。 23.(16分)一质量m=2.0kg的小物块以一定的初速度冲上一倾角为37º足够长的斜面,某同学利用传感器测出了小物块冲上斜面过程中多个时刻的瞬时速度,并用计算机做出了小物块上滑过程的速度-时间图线,如图所示。(取sin37º=0.6 cos37º=0.8 g =10m/s2)求: 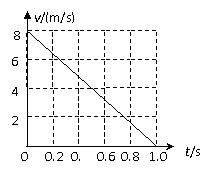 (1)小物块冲上斜面过程中加速度的大小; (1)小物块冲上斜面过程中加速度的大小;(2)小物块与斜面间的动摩擦因数; (3)小物块向上运动的最大距离。 24.(19分)一质量m=20kg的小车停放在光滑固定轨道ABCDE的A点处,如图所示,轨道的AB段是水平的,CDE段是一段R=20m的圆弧,圆弧的最高点D比AB高出h=1.25m.。有一质量M=60kg的人以v0的水平速度跳上小车,并与小车一起沿轨道滑行,不计一切阻力。试计算当人的速度v0多大时,小车滑行到D点时对轨道的压力恰好为零?(g取10m/s2)( 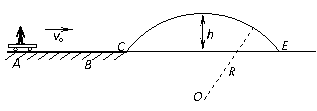 25.(20分)如图所示,真空中有(  ,0)为圆心,半径为 ,0)为圆心,半径为 的圆柱形匀强磁场区域,磁场的磁感应强度大小为B,方向垂直于纸面向里,在 的圆柱形匀强磁场区域,磁场的磁感应强度大小为B,方向垂直于纸面向里,在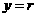 的虚线上方足够大的范围内,有方向水平向左的匀强电场,电场强度的大小为 的虚线上方足够大的范围内,有方向水平向左的匀强电场,电场强度的大小为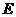 ,从 ,从 点向不同方向发射速率相同的质子,质子的运动轨迹均在纸面内,设质子在磁场中的偏转半径也为 点向不同方向发射速率相同的质子,质子的运动轨迹均在纸面内,设质子在磁场中的偏转半径也为 ,已知质子的电量为 ,已知质子的电量为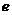 ,质量为 ,质量为 ,不计重力及阻力的作用,求 ,不计重力及阻力的作用,求(1)质子射入磁场时的速度大小 (2)速度方向沿 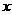 轴正方向射入磁场的质子,到达 轴正方向射入磁场的质子,到达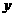 轴所需的时间 轴所需的时间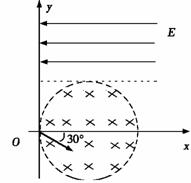 (3)速度方向与 (3)速度方向与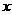 轴正方向成 轴正方向成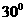 角(如图中所示)射入磁场的质子,到达 角(如图中所示)射入磁场的质子,到达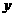 轴的位置坐标。要求画出质子运动轨迹的示意图。 轴的位置坐标。要求画出质子运动轨迹的示意图。26.(10分)五种短周期元素A、B、C、D、E,原子序数依次增大,C原子最外层电子数是A、B、D三种原子的最外层电子数之和, C可分别与A、B、D三种元素形成原子个数比为1:1的化合物甲、乙、丙,C与E是同族元素,B与E可形成原子个数比为1:2的化合物丁,E的最外层电子数是最内层电子数的3倍。请回答: (1)具有相同电子数和原子数的分子互称为等电子体,写出由短周期元素组成的与乙互为等电子体的分子__________(用化学式表示)。 (2) B的氧化物分子中各原子最外层均为8电子结构的电子式为 。 (3)丙中所含的化学键类型为 。把一定量的丙固体分别加入下列物质的溶液中,不可能出现浑浊现象的是 _________。 ①饱和H2S溶液 ②Na2SO3稀溶液 ③Ca(HCO3)2稀溶液 ④K2CO3稀溶液 (4)常温下丁是一种液体,加热到423K可与水反应生成两种酸性气体,写出此化学方程式。______________________________________________________ 27. (18分) A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。 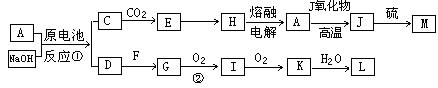 请回答以下问题: (1)写出原电池的负极反应方程式______________________________________。 (2)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为_________________(写出计算式);相同条件下,等浓度的C溶液与CH3COONa溶液中,C的阴离子与CH3COO-浓度的大小关系:前者_______后者(用“>”、“<”或“=”表示)。 (3)金属A的氯化物沸点较低,又易升华,能否电解这种熔融氯化物来生产A?__________。原因是________________________________________________________________。 (4)写出②的化学方程式____________________________________________________。 (5)写出A→J反应的化学方程式 。 (6)含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色。 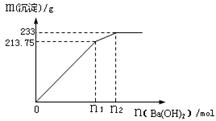 ①水溶液与NaHCO3溶液混合,反应的离子方程式为 ①水溶液与NaHCO3溶液混合,反应的离子方程式为___________ ___。 ②500mLX的溶液与Ba(OH)2反应生成沉淀的质量与加入Ba(OH)2物质的量的关系如图: 请回答:X晶体的俗名为__________;其溶液的物质的量浓度为_________mol/L。 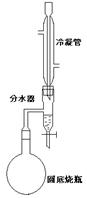 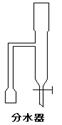 28.(15分)某实验小组欲制取苯甲酸乙酯(沸点213℃),主要实验仪器有:圆底烧瓶、分水器(如下图)、冷凝管,其他夹持装置及胶塞等略。 28.(15分)某实验小组欲制取苯甲酸乙酯(沸点213℃),主要实验仪器有:圆底烧瓶、分水器(如下图)、冷凝管,其他夹持装置及胶塞等略。实验步骤如下: I.取100ml圆底烧瓶,向其中分别加入以下三组试剂:①12.2g苯甲酸(其沸点为122℃,,相对分子质量为122)和2粒沸石②8ml(足量)无水乙醇 ③适量的浓硫酸 II. 如图所示连接实验装置,加热圆底烧瓶中的混合液,使反应产生的水蒸气经冷凝管冷凝回流到分水器中,通过分水器分离出来,用锥形瓶承接收集产生的水。 III. 当不再有水生成,停止加热。 IV. 冷却后,用饱和碳酸钠水溶液洗涤圆底烧瓶中的混合液并分液。 V. 取上层(有机层)混合液减压蒸馏,得到较为纯净的苯甲酸乙酯。 根据以上操作过程回答以下问题: (1)反应过程中浓硫酸有提高苯甲酸乙酯产率的作用,其原理为 (2)用冷凝管冷凝时,冷水应该从 口进入,从 口流出;(填“上”或“下”) (3)操作步骤IV中,用饱和碳酸钠溶液洗涤反应后的混合液目的是 ①洗去反应剩余的苯甲酸 ②洗去反应混合液中的乙醇 ③降低苯甲酸乙酯的溶解度,有利于析出、分层,便于下一步的分液 ④有利于苯甲酸乙酯的水解 (4)写出该反应的化学方程式 (5)实验过程中,如果温度过高会发生副反应,产生一种能使溴的四氯化碳溶液褪色的 无色稍有气味的气体,该气体的结构简式为 (6)实验结束收集分水器分离出的水,并测得质量为1.44g,计算苯甲酸乙酯的产率为 。实验中苯甲酸乙酯的实际产率总是小于此计算值,其原因可能是 ①加热过程中乙醇挥发,冷凝后滴入分水器中,随冷凝的水一起被分出 ②实验过程中,发生了副反应 ③苯甲酸乙酯洗涤、蒸发过程中有损失 29.(178分) 已知芳香族化合物A、B、C、D的化学式均满足C8H8Ox,请按要求回答下列问题: (1)A、B、C均为x=2的苯环上只有一个侧链的化合物,三者在碱性条件下可以发生如下反应: NaOH溶液 酸化   A
E(C7H6O2)+ F A
E(C7H6O2)+ FNaOH溶液 酸化   B
M(C6H6O)+ J B
M(C6H6O)+ JNaOH溶液 酸化   C N(C7H8O)+ P C N(C7H8O)+ P①写出C在NaOH溶液中应的化学方程式 。 反应类型为 。 ②设计实验鉴别E、M、N(填写下列表格,步骤可不填满)
(2)D为x=3的芳香族化合物,请写出两个只有两个对位取代基,且能发生银镜反应的有机物的结构简式 。 (3)当x=4时其中有一种化合物的结构简式为:
请用化学式填写下列空白处所需加入的适当试剂① ② ③ 。 0 122585 122593 122599 122603 122609 122611 122615 122621 122623 122629 122635 122639 122641 122645 122651 122653 122659 122663 122665 122669 122671 122675 122677 122679 122680 122681 122683 122684 122685 122687 122689 122693 122695 122699 122701 122705 122711 122713 122719 122723 122725 122729 122735 122741 122743 122749 122753 122755 122761 122765 122771 122779 447348 |
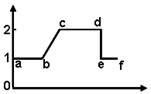 A.若该图表示有丝分裂,则染色体的交叉互换和基因重组都发生在ac时期
A.若该图表示有丝分裂,则染色体的交叉互换和基因重组都发生在ac时期 下列坐标曲线中,a.b所表示的含义正确的是
下列坐标曲线中,a.b所表示的含义正确的是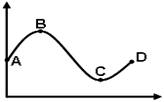 根据如图所示坐标曲线回答,正确的是
根据如图所示坐标曲线回答,正确的是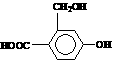 为实现以下物质的转化
为实现以下物质的转化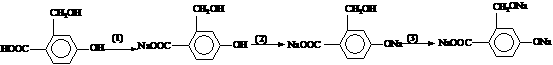

 时小物块开始滑动,此时停止转动木板,小物块滑到底端的速度为v,则在整个过程中
时小物块开始滑动,此时停止转动木板,小物块滑到底端的速度为v,则在整个过程中  A.支持力对物块做功为0
A.支持力对物块做功为0