27、(7分)某实验小组的四位同学在探究碱的性质时发现氢氧化钠、氢氧化钙等可溶性碱都能使酚酞试液变红。他们想进一步探究:不溶性的氢氧化镁是否也能使酚酞试液变红。为此,他们将适量的氢氧化镁加入到盛有热水的烧杯中搅拌,然后向浑浊的液体中滴加酚酞试液,发现酚酞试液变红,可是过一会儿红色又消失了。
[提出问题]上述酚酞试液变红、红色又消失的原因是什么?
[作出猜想]小明:可能是个偶然现象。
小东:可能是浑浊液中的固体氢氧化镁使酚酞试液变红,氢氧化镁沉降后溶液就变无色了。
小花:可能是酚酞试液与空气中的氧气反应,使红色消失;也可能是氢氧化镁溶液与空气
中的二氧化碳反应的缘故。
小红:可能是在热水中氢氧化镁的溶解度大,溶液中OH一离子较多,使酚酞试液变红;过一会儿温度降低,氢氧化镁的溶解度减小,溶液中OH一离子变少,酚酞试液又变无色。
[讨论交流]
(1)对小明猜想“是个偶然现象”,四位同学都认为可以用科学探究的一般方法排除偶然现象。他们的方法是: 。
(2)小花认为小东的猜想不正确,她从碱使酚酞试液变色的原因上给予了否定:
。
[实验验证]
(1)四位同学讨论后认为要验证小花的猜想,还需做如下实验,你知道其实验的目的吗?
|
实验步骤 |
设计目的 |
|
将氢氧化镁加入到热水中搅拌,滴入酚酞试液,并在上方滴一些植物油。 |
|
(2)小红设计了如下对比实验方案证明自己的猜想,请将其方案补充完整。
|
实验方法 |
可能观察到的现象 |
结论 |
|
|
|
红色消失与氢氧化镁的溶解度随温度降低而减小有关 |
[反思提高]将氢氧化镁加入到热水中搅拌,所得溶液的pH 7(填“<”、“>”、“=”);冷却后pH 。(填“变大”、“变小”或“不变”)
24.(5分)元素周期表是化学和研究化学的重要工具,它的内容十分丰富,下图是依据元素周期表画出的1~18号元素的原子结构示意图。请对它进行探究:
|
第一周期 |
1 H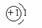 |
|
|
|
|
|
|
2 He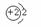 |
|
第二周期 |
3 Li |
4 Be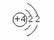 |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
|
第三周期 |
11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
(1)原子序数为17的元素名称是_______,在化学反应中,该元素的原子容易_____(填“得”或“失”)电子;原子序数为13的元素属于________元素(填“金属”或“非金属”)。
(2)请从上表中总结出一条原子排布的规律 。
(3)研究表明:第二周期从3号到9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力增大,故原子半径逐渐减小。请判断:钠原子半径_____镁原子半径(填“﹤”或“﹥”或“﹦”)。
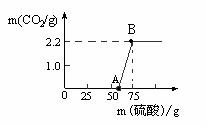 该样品中Na2CO3的质量为多少?
该样品中Na2CO3的质量为多少?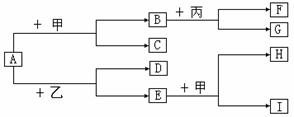
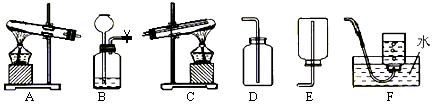
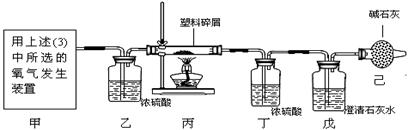 两种元素),他们设计了如下图所示的实验装置,使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量。
两种元素),他们设计了如下图所示的实验装置,使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量。 (5分)下图是配制一定质量分数的NaCl溶液的操作过程。请回答下列问题:
(5分)下图是配制一定质量分数的NaCl溶液的操作过程。请回答下列问题: (1)“祥云”火炬燃料为丙烷,丙烷在空气中完全燃烧后的产物是CO2和H2O,对环境没有污染。丙烷完全燃烧的化学方程式是
。
(1)“祥云”火炬燃料为丙烷,丙烷在空气中完全燃烧后的产物是CO2和H2O,对环境没有污染。丙烷完全燃烧的化学方程式是
。