4.归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可整理出如下表所示部分数据和性质。请根据下表回答问题:
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
原子半径(nm) |
0.066 |
0.104 |
0.117 |
0.137 |
|
主要化合价 |
-2 |
-2,+4,+6 |
|
-2、+4、+6 |
|
常况下单质色态 |
无色气体 |
淡黄色固体 |
灰色固体 略带金属光泽的 |
|
|
主要单质熔点(℃) |
-218.4 |
113 |
217 |
450 |
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
(1)碲的常况下单质的色态为 ;硒最稳定化合价可能是__________。
(2)氧只能与周期表中某一种元素反应生成+2价化合物,该化合物的化学式为 ;氧族元素中含有18e-的两种氢化物的化学式为 。
(3)氢硒酸敞放在空气中易变质,其可能发生的化学方程式为___ ___ ___。
 (4)工业上用Al2Te3来制备H2Te,请完成化学方程式:__A12Te3+___( )==___A1(OH)3↓+___H2Te↑
(4)工业上用Al2Te3来制备H2Te,请完成化学方程式:__A12Te3+___( )==___A1(OH)3↓+___H2Te↑
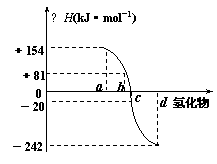
(5)已知:在298K、1.01×105Pa(标准热力学状态)下,
由稳定的单质发生反应生成1mol化合物的反应热叫该化合
物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的
生成热数据示意图。试回答下列问题:
①请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系 。
②写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式为 。
(6)工业上常用价格便宜的Na2S代替NaOH作为碱来使用,结合离子方程式解释其原因: 。
二卷强化训练(化学反应与能量)
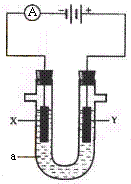 (15分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(15分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: