摘要:6.把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应.所得溶液中的金属离子 A. 是Fe3+和Cu2+ B. 是Fe2+和Cu2+ C. 是Fe2+和Fe3+ D. 只有Fe2+
网址:http://m.1010jiajiao.com/timu3_id_112518[举报]
 (2012?广安)工业明胶是用工业皮革废料,经生石灰浸渍膨胀等工序制成的“蓝皮胶”,被不法商人添加食品、药品中,变成“毒食”、“毒胶囊”.经检测,“毒食”和“毒胶囊”中铬超标数十倍,食用后对肝、肾会造成极大伤害,导致癌症.
(2012?广安)工业明胶是用工业皮革废料,经生石灰浸渍膨胀等工序制成的“蓝皮胶”,被不法商人添加食品、药品中,变成“毒食”、“毒胶囊”.经检测,“毒食”和“毒胶囊”中铬超标数十倍,食用后对肝、肾会造成极大伤害,导致癌症.(1)上述中的“铬”是指
C
C
(填序号).A、单质 B、原子 C、元素 D、分子
(2)如图是元素周期表中的一格,从图中获得的信息正确的是
D
D
(填序号)A、该元素的质子数是52 B、该元素在地壳中的含量为24%
C、该元素属于非金属元素 D、该元素的一个原子核中含有28个中子
(3)交警常用装有重铬酸钾的仪器检测司机是否酒后驾车,因为酒精可以使橙红色的重铬酸钾变为绿色的硫酸铬,硫酸铬[Cr2(SO4)3]中铬元素的化合价为
+3
+3
价.(4)铬是最硬的金属,常镀在金属制品和水龙头的表面,使金属制品美观耐用.若将打磨的相同大小的铬片、铝片和铜片分别置于等质量分数的稀硫酸中,观察到铬片表面慢慢产生气泡,铝片表面迅速产生较多气泡,铜片表面无现象.请写出铬、铝、铜金属活动性由强到弱的顺序是
铝、铬、铜
铝、铬、铜
.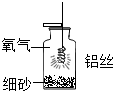 (2013?化州市一模)小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧,于是设计了如右图所示的装置进行实验探究,请你结合实验过程回答下列问题.
(2013?化州市一模)小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧,于是设计了如右图所示的装置进行实验探究,请你结合实验过程回答下列问题.(1)集气瓶底预先铺少量沙子的目的是
防止生成物熔化落下时炸裂瓶底.
防止生成物熔化落下时炸裂瓶底.
.(2)铝丝下端系一根火柴的目的是:
引燃铝丝
引燃铝丝
.(3)用正确方法引燃铝丝,伸入装有氧气的集气瓶中后,未观察到铝丝发生剧烈燃烧现象,可能的原因是
铝丝表面有氧化物
铝丝表面有氧化物
.(4)某化学兴趣小组的同学经查阅资料得知:人呼吸中各种气体的体积分数如表所示:
| 气体 | 吸入气体 | 呼出气体 |
| X | 78% | 75% |
| Y | 21% | 15% |
| 二氧化碳 | 0.03% | 3.68% |
| 水 | 0.02% | 5.44% |
| 其它 | 0.95% | 0.88% |
氮气
氮气
,Y是氧气
氧气
;②欲证明人呼出的气体中含有水蒸气,其实验方法是
对着干燥的玻璃片(或镜子)呼气,玻璃片(或镜子)表面出现水滴
对着干燥的玻璃片(或镜子)呼气,玻璃片(或镜子)表面出现水滴
.40、铝是重要的轻金属,广泛应用于航空、电讯和建筑等领域.铝亦有其特殊的性质,试根据以下信息填空或简答.
(1)按金属的活动性顺序,铝比锌
注:“一”表示铝表面产生气泡很小且慢;“+”表示铝表面产生气泡较大且快.
“1:4”表示用1体积的37%浓盐酸与4体积的水混合所得溶液.
根据上述表格内容,你认为铝与酸反应产生氢气的速率,除了跟酸溶液中氢离子浓度有关外,还可能受到
(2)小芳将长条状铝片的一端放在酒精灯火焰上灼烧片刻,轻轻摇动铝条,受热一端会左右摇晃,却不像蜡烛那样滴落.为究其原因,小芳查阅资料得知:铝的熔、沸点分别是660℃、2460℃;氧化铝的熔、沸点分别为2054℃、2980℃.
请解释上述实验现象:
查看习题详情和答案>>
(1)按金属的活动性顺序,铝比锌
强
.但是将铝片和锌粒分别投入稀硫酸中,铝片表面产生的气泡却比锌粒少而慢.为了探究铝与酸反应的规律,小强将已被砂纸打磨过的相同大小的6枚铝片,分别放人下表所示溶液中进行实验
| 溶液 | 现象 | 溶液 | 现象 | 溶液 | 现象 |
| ①稀硫酸 | 一 | ③稀硫酸(加入少量Na2SO4固体) | 一 | ⑤盐酸 (1:4) |
+ |
| ②稀硫酸 (加热) |
+ | ④稀硫酸(加入少量NaCl固体) | + | ⑥盐酸 (37%) |
++ |
“1:4”表示用1体积的37%浓盐酸与4体积的水混合所得溶液.
根据上述表格内容,你认为铝与酸反应产生氢气的速率,除了跟酸溶液中氢离子浓度有关外,还可能受到
温度
、酸的种类
、酸中含有的盐的种类
等多种因素的影响.(2)小芳将长条状铝片的一端放在酒精灯火焰上灼烧片刻,轻轻摇动铝条,受热一端会左右摇晃,却不像蜡烛那样滴落.为究其原因,小芳查阅资料得知:铝的熔、沸点分别是660℃、2460℃;氧化铝的熔、沸点分别为2054℃、2980℃.
请解释上述实验现象:
因为铝在加热的条件下能和空气中的氧气反应生成氧化铝,氧化铝的熔点和沸点很高,不容易熔化.
.
将一块质量为7.5克表面蒙有氧化物的锌片,放入浓度为30%的稀硫酸中,充分反应后得到的气体恰好与7.95克的一种不溶于水的黑色粉末完全反应,得到一种不与盐酸反应的红色金属,求此锌片的纯度.
查看习题详情和答案>>
15、铝是重要的轻金属,广泛应用于航空、电讯和建筑等领域.铝亦有其特殊的性质,试根据以下信息填空或简答.
(1)按金属的活动性顺序,铝比锌
注:“-”表示铝表面产生气泡很小且慢;“+”表示铝表面产生气泡较大且快.“1:4”表示用1体积的37%浓盐酸与4体积的水混合所得溶液.
根据上述表格内容,你认为铝与酸反应产生氢气的速率,除了跟酸溶液中氢离子浓度有关外,还可能受到
(2)小芳将成条状铝片一端放在酒精灯火焰上灼烧片刻,轻轻摇动铝条,受热一端会左右摇晃,却不像蜡烛那样滴落.为究其原因,小芳查阅资料得知:铝的熔、沸点分别是660℃、2460℃;氧化铝的熔、沸点分别是2054℃、2980℃.
请解释上述实验现象:
查看习题详情和答案>>
(1)按金属的活动性顺序,铝比锌
活泼
.但是将铝片和锌粒分别投入稀硫酸中,铝片表面产生的气泡却比锌粒少而慢.为了探究铝与酸反应的规律,小强将已被砂纸打磨讨的相同大小的6枚铝片,分别放入下表所示溶液中进行实验.| 溶液 | 现象 | 溶液 | 现象 | 溶液 | 现象 |
| ①稀硫酸 | 一 | ③稀硫酸(加入少量NaSO4固体) | 一 | ⑤盐酸(1:4) | + |
| ②稀硫酸(加热) | + | ④稀硫酸(加入少量NaCl固体) | + | ⑥盐酸(37%) | ++ |
根据上述表格内容,你认为铝与酸反应产生氢气的速率,除了跟酸溶液中氢离子浓度有关外,还可能受到
温度
、酸的种类
、酸的浓度
等多种因素的影响.(2)小芳将成条状铝片一端放在酒精灯火焰上灼烧片刻,轻轻摇动铝条,受热一端会左右摇晃,却不像蜡烛那样滴落.为究其原因,小芳查阅资料得知:铝的熔、沸点分别是660℃、2460℃;氧化铝的熔、沸点分别是2054℃、2980℃.
请解释上述实验现象:
铝受热熔化后跟空气中氧气反应生成氧化铝
.