6. 利用氢气还原氧化铜实验测定水的组成(如图所示)。请回答下列问题:
利用氢气还原氧化铜实验测定水的组成(如图所示)。请回答下列问题:
(1)实验中,用锌粒和稀硫酸反应制取氢气。
①检验了氢气的纯度后,应先通一段时间氢气,再加热氧化铜进行反应,其主要目的是_______________________________________________。
②跟氧化铜反应前,应将制取的氢气通过如25题图中所示的装置,其中所盛试剂应该是______________。
(2)实验中,某次测定的数据如下表所示:
|
|
实验前 |
实验后 |
|
氧化铜和玻璃的总质量 |
65.6 g |
59.2 g |
|
氯化钙和U型管的总质量 |
100.8 g |
108.0
g |
根据数据计算生成的水中,氧、氢元素的质量比(要求有计算式):
(3)下列情况中,对实验测定结果一定没有影响的是(填序号)_______________。
①对CuO而言,H2是过量的;②CuO粉末中含有不与H2反应的杂质;③反应中部分CuO变成Cu2O;④干燥剂CaCl2有部分失效;⑤用NaOH代替CaCl2作干燥剂。
|
实验内容和步骤 |
实验现象 |
结论(或化学方程式) |
|
①称量10.0g粗锌放在铜网中,按图示装置组装后,称得仪器和药品总质量为120.0g |
∕ |
∕ |
|
②将铜网插入足量稀盐酸中,充分反应 |
|
化学方程式: |
|
③反应完全后,称得装置总质量为119.8g |
∕ |
产生H2的质量为 g。 粗锌的纯度为 。 |

 (3)若将图中药水瓶改成直导管、粗锌换成纯锌,用原方案测定锌的相对原子质量,则结果
。(填“偏大”、“偏小”、“无影响”)
(3)若将图中药水瓶改成直导管、粗锌换成纯锌,用原方案测定锌的相对原子质量,则结果
。(填“偏大”、“偏小”、“无影响”) 某化学兴趣小组的同学的从山上, 发现一块绿色矿石,非常好奇,就拿到化学实验室通过实验探究该矿石的元素组成,设计实验如下实验,完全反应后:
某化学兴趣小组的同学的从山上, 发现一块绿色矿石,非常好奇,就拿到化学实验室通过实验探究该矿石的元素组成,设计实验如下实验,完全反应后: 碳酸钠和氯化钠的混合物14克,常温下溶解在水中 生成CaCO3质量
碳酸钠和氯化钠的混合物14克,常温下溶解在水中 生成CaCO3质量
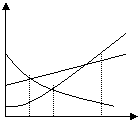 右图是A、B、C三种物质的溶解度曲线,
S(克)
右图是A、B、C三种物质的溶解度曲线,
S(克)