9.为了测定某种硫酸铜晶体(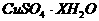 )中的X值,做下列实验。
)中的X值,做下列实验。
将含结晶水的硫酸铜放在坩埚中加热,直到不含结晶水为止( ),冷却至室温,称量测得的数据为:
),冷却至室温,称量测得的数据为:
|
|
质量/g |
|
坩埚+硫酸铜晶体 |
21.26 |
|
坩埚+无水硫酸铜 |
20.72 |
|
坩埚 |
19.13 |
根据实验数据,经计算得X=___________。
9.为了测定某种硫酸铜晶体(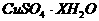 )中的X值,做下列实验。
)中的X值,做下列实验。
将含结晶水的硫酸铜放在坩埚中加热,直到不含结晶水为止( ),冷却至室温,称量测得的数据为:
),冷却至室温,称量测得的数据为:
|
|
质量/g |
|
坩埚+硫酸铜晶体 |
21.26 |
|
坩埚+无水硫酸铜 |
20.72 |
|
坩埚 |
19.13 |
根据实验数据,经计算得X=___________。