18. 将8 g硫粉分别在一定量的氧气中充分燃烧,实验如下:
|
|
第一次 |
第二次 |
第三次 |
|
氧气的质量/ g |
5 |
8 |
16 |
|
生成SO2的质量 / g |
10 |
16 |
16 |
(1) 这三次实验中,哪次符合质量守恒定律?为什么?
(2) 第一次为什么是生成10 g二氧化硫,而不是13 g二氧化硫?哪种物质有剩余?
(3) 第三次为什么是生成16 g二氧化硫,而不是24 g二氧化硫?哪种物质有剩余?
(4) 求二氧化硫中硫元素和氧元素的质量比。
答:(1) 表面看只有第二次符合质量守恒定律,实际上都符合。因为第一次是硫有剩余,第三次是氧有剩余。而质量守恒定律是指参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和,所以三次实验都符合。
(2) 第一次是因为有一部分硫没有参加反应,剩余物质是硫,为3 g。
(3) 第三次是因为有一部分氧气没有参加反应,剩余物质是氧气,为8 g。
(4) 由第二次可知,16 g二氧化硫中含有8 g硫元素和8 g氧元素,所以硫元素与氧元素的质量比为1∶1。
链接中考:
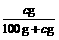 ×100%计算,也可以用
×100%计算,也可以用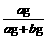 计算,则该NaCl溶液是
溶液。(填“饱和”或“不饱和”)
计算,则该NaCl溶液是
溶液。(填“饱和”或“不饱和”)