题目内容
某无色溶液,其中有可能存在的离子如下:Ag+、Na+?、Ba2+?、Al3+、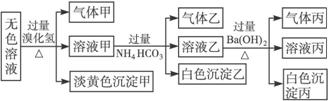
请回答下列问题:(1)沉淀甲是________,生成沉淀甲的离子方程式为________________。
(2)沉淀乙是_______,由溶液甲生成沉淀乙的离子方程式为______________________。
(3)沉淀丙是_______,如何用一化学实验来确定其成分?________________________。
(4)气体甲的成分有哪几种可能?___________________________。
(5)综合上述信息,可以肯定存在的离子有__________________________。
解析:首先分析4种阳离子与5种阴离子的共存关系,因为Ag+与所有的5种阴离子不可大量共存,立即排除Ag+,从而将沉淀甲锁定为S(即排除AgBr)。S沉淀生成的条件需要![]() 在酸性条件下与S2-反应,进一步可推得Ba2+不存在,再得沉淀乙只能是Al元素引起的沉淀Al(OH)3,对沉淀丙的分析:可由溶液乙的成分出发,乙溶液中的阴离子有过量余下的
在酸性条件下与S2-反应,进一步可推得Ba2+不存在,再得沉淀乙只能是Al元素引起的沉淀Al(OH)3,对沉淀丙的分析:可由溶液乙的成分出发,乙溶液中的阴离子有过量余下的![]() 及可能原溶液中的
及可能原溶液中的![]() ,故丙沉淀为BaCO3或BaCO3、BaSO4两者的混合物。对Na+的判断可从溶液电中性的角度思考。然后利用题给反应信息再结合离子共存关系,则能顺利解答。
,故丙沉淀为BaCO3或BaCO3、BaSO4两者的混合物。对Na+的判断可从溶液电中性的角度思考。然后利用题给反应信息再结合离子共存关系,则能顺利解答。
本题若第一印象见到加入氢溴酸即产生淡黄色沉淀一定是AgBr,则误入歧途,无法得到正确答案。
答案:(1)S 2S2-+![]() +6H+====3S↓+3H2O
+6H+====3S↓+3H2O
(2)Al(OH)3 Al3++3![]() ====Al(OH)3↓+3CO2↑
====Al(OH)3↓+3CO2↑
(3)BaCO3或BaCO3和BaSO4的混合物 在所得沉淀中加入足量稀盐酸,若沉淀不能全部溶解说明中有BaSO4,若全溶解则为BaCO3
(4)CO2、H2S、SO2、H2S和CO2或SO2和CO2
(5)S2-、![]() 、
、![]() 、Na+
、Na+

