题目内容
某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32- 、SO42-。现取该溶液进行有关实验,实验结果如下图所示: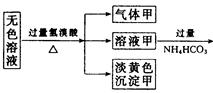
(1)沉淀甲是 ,生成沉淀的离子方程式 。
(2)沉淀乙是 ,由溶液甲生成沉淀乙的离子方程式 。
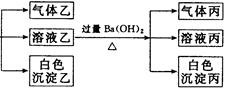
(3)沉淀丙是 。
(4)综合上述信息,可以肯定存在的离子有 。
(1)S; 2S2-+SO32-+6H+=3S↓+3H2O
(2)Al(OH)3; Al3++3HCO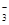 =Al(OH)3↓+3CO2↑
=Al(OH)3↓+3CO2↑
(3)BaCO3, 可能有BaSO4; 在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3外还有BaSO4;若全部溶解,则仅有BaCO3.
(4) S2-、SO 、AlO
、AlO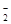 、Na+
、Na+
解析

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
