摘要:23. J.L.M.R.T是原子序数依次增大的短周期主族元素.J.R在周期表中的相对位置如右表,J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素. (1)M的离子结构示意图为 ;元素T在周期表中位于第 族. (2)J和氢组成的化合物分子有6个原子.其结构简式为 . (3)M和T形成的化合物在潮湿的空气中冒白色烟雾.反应的化学方程式为 . (4)L的最简单气态氢化物甲的水溶液显碱性. ①在微电子工业中.甲的水溶液可作刻蚀剂H2O2 的清除剂.所发生反应的产物不污染环境.其化学方程式为 . ②一定条件下.甲在固定体积的密闭容器中发生分解反应并达平衡后.仅改变下表中反应条件x.该平衡体系中随x递增y递减的是 . 选项 a b c d x 温度 温度 加入H2的物质的量 加入甲的物质的量 y 甲的物质的量 平衡常数K 甲的转化率 生成物物质的量总和 (5)由J.R形成的液态化合物JR2 0.2mol在O2中完全燃烧.生成两种气态氧化物.298K时放出热量215kJ. 该反应的热化学方程式为 . 解析: (1) J元素最低负化合价的绝对值与其原子最外层电子数相等,可以判断J元素为碳元素,M是地壳中含量最多的金属元素为铝元素,根据J.R在周期表中的相对位置可以判断R为硫元素.则T为氯元素.处于第三周期第七主族 (2)J和氢组成含有6个原子的分子为乙烯.其结构简式为 (3)M和T形成的化合物为.与水反应.其中氯化氢气体呈雾状 (4)①氨水与双氧水发生氧化还原反应: 生成无污染的氮气, ②甲在固体体积的密闭容器中发生分解反应.表明正反应为吸热反应.升高温度.平衡朝着正方向移动.甲物质的量减少,加入的物质的量即增加生成物的浓度.平衡朝逆方向移动.甲的转化率减小 (5)JR2为CS2,燃烧生成二氧化碳和二氧化硫.依题意可以很快的写出反应的热化学方程式 答案:(1) , ⅦA (2) (3). (4)① ②a和c;a或c (5)
网址:http://m.1010jiajiao.com/timu3_id_88443[举报]
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素为构成有机物的必备元素;L的最简单气态氢化物甲的水溶液显碱性;M是地壳中含量最多的金属元素.
(1)M的离子结构示意图为 ;元素T在周期表中位于第 周期第 族.
(2)J元素是 (用元素符号表示);J和氢组成的10电子化合物的化学式为 .
(3)M和T形成的化合物属于 (填“离子化合物”、或“共价化合物”)
(4)元素M形成的简单离子的水溶液与甲的水溶液反应的离子方程式 .
查看习题详情和答案>>
| J | ||||
| R |
(2)J元素是
(3)M和T形成的化合物属于
(4)元素M形成的简单离子的水溶液与甲的水溶液反应的离子方程式
 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.(1)M的离子结构示意图为


ⅦA
ⅦA
族.(2)J和氢组成的化合物分子有4个原子,其结构式为
CH≡CH
CH≡CH
.(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为
AlCl3+3H2O=Al(OH)3+3HCl↑
AlCl3+3H2O=Al(OH)3+3HCl↑
.(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为
NH3?H2O+3H2O2=N2+8H2O
NH3?H2O+3H2O2=N2+8H2O
.②由甲与氧气、KOH 溶液构成原电池,负极会产生L的单质.则其负极反应式为
2NH3-6e-+6OH-═N2+6H2O
2NH3-6e-+6OH-═N2+6H2O
.(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol
.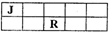 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.(1)元素T在周期表中位于第
ⅦA
ⅦA
族.(2)M和T形成的化台物在潮湿的空气中形成酸雾,反应的化学方程式为
AlCl3+3H2O?Al(OH)3+3HCl
AlCl3+3H2O?Al(OH)3+3HCl
.(3)L的最简单气态氢化物甲的水溶液显碱性.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
2NH3?H2O+3H2O2═N2↑+8H2O
2NH3?H2O+3H2O2═N2↑+8H2O
.已知:J、L、M、R、T是原子序数依次增大的短周期主族元素;J元素最低负化合价的绝对值与其原子最外层电子数相等;L的最简单气态氢化物甲的水溶液显碱性;M是地壳中含量最多的金属元素;R形成简单的阴离子R2-与Ar的电子层结构相同.则
(1)M的离子电子式为
(2)元素T在周期表中的位置是
(3)用电子式表式JR2的形成过程
 ;
;
(4)M和T形成的化合物(MT3)在潮湿的空气中冒白色烟雾,反应的化学方程式为:
(5)在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为
查看习题详情和答案>>
(1)M的离子电子式为
Al3+
Al3+
;(2)元素T在周期表中的位置是
第三周期ⅦA族
第三周期ⅦA族
;(3)用电子式表式JR2的形成过程


(4)M和T形成的化合物(MT3)在潮湿的空气中冒白色烟雾,反应的化学方程式为:
AlCl3+3H2O?Al(OH)3+3HCl
AlCl3+3H2O?Al(OH)3+3HCl
.(提示:此反应为非氧化还原反应).(5)在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为
2NH3?H2O+3H2O2═N2+8H2O
2NH3?H2O+3H2O2═N2+8H2O
.(2011?南开区二模)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、M、R在周期表中的相对位置如表:J元素最低负化合价的绝对值与其原子最外层电子数相等.
请回答下列问题:
(1)M的离子结构示意图为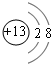
 ;元素R在周期表中位于第
;元素R在周期表中位于第
(2)J和氢组成的化合物分子有6个原子,其结构简式为
(3)M和T形成的化合物水溶液显
(4)L的最简单气态氢化物甲的水溶液显碱性.一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0并达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是
(5)将T的气态单质通入冷的消石灰中可制得漂白粉,写出漂白粉溶液在空气中失效的化学方程式为
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为
查看习题详情和答案>>
| J | ||||
| M | R |
(1)M的离子结构示意图为


ⅥA
ⅥA
族.(2)J和氢组成的化合物分子有6个原子,其结构简式为
CH2=CH2
CH2=CH2
.(3)M和T形成的化合物水溶液显
酸
酸
性,用离子方程式解释原因Al3++2H2O?Al(OH)3+3H+
Al3++2H2O?Al(OH)3+3H+
.(4)L的最简单气态氢化物甲的水溶液显碱性.一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0并达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是
ad
ad
(选填序号).| 选项 | a | b | c | d |
| x | 温度 | 加入H2的物质的量 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO
2HCl+O2↑
| ||
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO
2HCl+O2↑
.
| ||
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol
.