题目内容
 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.(1)M的离子结构示意图为


ⅦA
ⅦA
族.(2)J和氢组成的化合物分子有4个原子,其结构式为
CH≡CH
CH≡CH
.(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为
AlCl3+3H2O=Al(OH)3+3HCl↑
AlCl3+3H2O=Al(OH)3+3HCl↑
.(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为
NH3?H2O+3H2O2=N2+8H2O
NH3?H2O+3H2O2=N2+8H2O
.②由甲与氧气、KOH 溶液构成原电池,负极会产生L的单质.则其负极反应式为
2NH3-6e-+6OH-═N2+6H2O
2NH3-6e-+6OH-═N2+6H2O
.(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol
.分析:J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可知J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,应为Al元素,而T是原子序数最大的元素,且为短周期主族元素,应为Cl元素,根据元素周期律的递变规律及元素的单质、化合物的性质来解答该题.
解答:解:J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可知J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,应为Al元素,而T是原子序数最大的元素,且为短周期主族元素,应为Cl元素,
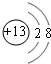
(1)M为Al,质子数为13,其离子结构示意图为 ,T为Cl,位于第ⅦA族,故答案为:
,T为Cl,位于第ⅦA族,故答案为: ;ⅦA;
;ⅦA;
(2)J和氢组成的化合物分子有4个原子,为乙炔,结构简式为CH≡CH,故答案为:CH≡CH;
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,发生水解反应,该反应为AlCl3+3H2O=Al(OH)3+3HCl↑,故答案为:AlCl3+3H2O=Al(OH)3+3HCl↑;
(4)①L为N元素,其氢化物诶氨气,与过氧化氢反应生成氮气和水,反应为NH3?H2O+3H2O2=N2+8H2O,故答案为:NH3?H2O+3H2O2=N2+8H2O;
②氨气与氧气、KOH 溶液构成原电池,负极会产生氮气,则负极反应为2NH3-6e-+6OH-═N2+6H2O,故答案为:2NH3-6e-+6OH-═N2+6H2O;
(5)JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物为二氧化碳和二氧化硫,298K时放出热量215kJ,则1mol二硫化碳完全燃烧生成稳定氧化物放出的热量为1075kJ,则热化学反应方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol,故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol.
(1)M为Al,质子数为13,其离子结构示意图为
 ,T为Cl,位于第ⅦA族,故答案为:
,T为Cl,位于第ⅦA族,故答案为: ;ⅦA;
;ⅦA;(2)J和氢组成的化合物分子有4个原子,为乙炔,结构简式为CH≡CH,故答案为:CH≡CH;
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,发生水解反应,该反应为AlCl3+3H2O=Al(OH)3+3HCl↑,故答案为:AlCl3+3H2O=Al(OH)3+3HCl↑;
(4)①L为N元素,其氢化物诶氨气,与过氧化氢反应生成氮气和水,反应为NH3?H2O+3H2O2=N2+8H2O,故答案为:NH3?H2O+3H2O2=N2+8H2O;
②氨气与氧气、KOH 溶液构成原电池,负极会产生氮气,则负极反应为2NH3-6e-+6OH-═N2+6H2O,故答案为:2NH3-6e-+6OH-═N2+6H2O;
(5)JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物为二氧化碳和二氧化硫,298K时放出热量215kJ,则1mol二硫化碳完全燃烧生成稳定氧化物放出的热量为1075kJ,则热化学反应方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol,故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol.
点评:本题考查位置、结构、性质的关系及应用,元素的推断是解答本题的关键,涉及原子结构、氧化还原反应、水解反应、原电池、热化学反应方程式,侧重性质和反应原理的考查,注重高考考点的训练,题目难度中等.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
 (2010?福建)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(2010?福建)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
 Al(OH)3+3HCl
Al(OH)3+3HCl
 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.