摘要:2.熟练掌握常见单质.化合物的制备方法
网址:http://m.1010jiajiao.com/timu3_id_82408[举报]
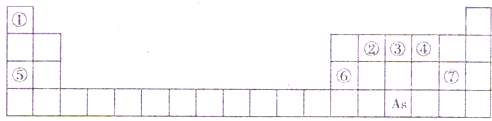
(2011?万州区一模)元素周期表是人们研究物质性质的重要工具.下表是元素周期表的一部分,A、B、C、D、E、X、Y是该表中给出元素组成的常见单质或化合物.
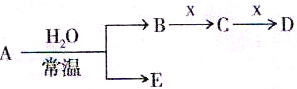
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去):
(1)As在周期表中的位置
(2)若E为单质气体,D为白色沉淀,A的化学式可能是
(3)若E为氧化物,X是碱性盐溶液,C为无色无味的气体,且C分子中有22个电子,则A的化学式为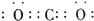
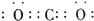 ,A与水反应的化学方程式为
,A与水反应的化学方程式为
(4)Y由④⑤⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂.As可与Y的水溶液反应,生成As最高价含氧酸,该反应的化学方程式为
查看习题详情和答案>>

已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去):

(1)As在周期表中的位置
第四周期第VA族
第四周期第VA族
;(2)若E为单质气体,D为白色沉淀,A的化学式可能是
Na、Na2O2或NaH
Na、Na2O2或NaH
,B含有的化学键类型为离子键和极性共价键
离子键和极性共价键
,B与X反应的离子方程式为Al3++4OH-═AlO2-+2H2O
Al3++4OH-═AlO2-+2H2O
;(3)若E为氧化物,X是碱性盐溶液,C为无色无味的气体,且C分子中有22个电子,则A的化学式为
NO2
NO2
,C的电子式为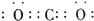
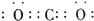
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
;(4)Y由④⑤⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂.As可与Y的水溶液反应,生成As最高价含氧酸,该反应的化学方程式为
5NaClO+2As+3H2O═2H3AsO4+5NaCl
5NaClO+2As+3H2O═2H3AsO4+5NaCl
.如图1是元素周期表的一部分.
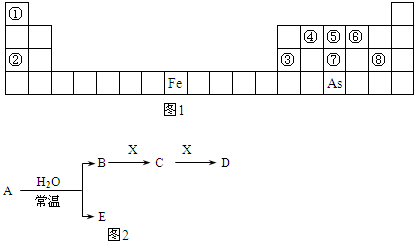
Ⅰ.用化学用语回答下列问题:
(1)②、⑥、⑧的离子半径由大到小的顺序为
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
(3)As的原子结构示意图为
 ;其氢化物的化学式为
;其氢化物的化学式为
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂.As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
Ⅱ.A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物.已知A、B、C、D、E、X存在如图2所示转化关系(部分生成物和反应条件略去).
若常温下A为红棕色气体,B为强酸,X为常见金属单质
(5)A与水反应的化学方程式为
(6)工业上常用热还原法冶炼X,写出其化学方程式
(7)某温度下(>100℃)若m克X与H2O反应放出QKJ (Q>O)的热量.写出该反应的热化学方程式
(8)少量X与B的稀溶液反应生成C的离子反应方程式为
查看习题详情和答案>>

Ⅰ.用化学用语回答下列问题:
(1)②、⑥、⑧的离子半径由大到小的顺序为
Clˉ>O2ˉ>Na+
Clˉ>O2ˉ>Na+
.(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
HClO4>H3PO4>H2CO3
HClO4>H3PO4>H2CO3
.(3)As的原子结构示意图为


AsH3
AsH3
.(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂.As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
5NaClO+2As+3H2O═2H3AsO4+5NaCl
5NaClO+2As+3H2O═2H3AsO4+5NaCl
,当消耗1mol还原剂时,电子转移了5
5
mol.Ⅱ.A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物.已知A、B、C、D、E、X存在如图2所示转化关系(部分生成物和反应条件略去).
若常温下A为红棕色气体,B为强酸,X为常见金属单质
(5)A与水反应的化学方程式为
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(6)工业上常用热还原法冶炼X,写出其化学方程式
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(7)某温度下(>100℃)若m克X与H2O反应放出QKJ (Q>O)的热量.写出该反应的热化学方程式
3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)△H=-
kJ/mol
| 168Q |
| m |
3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)△H=-
kJ/mol
.| 168Q |
| m |
(8)少量X与B的稀溶液反应生成C的离子反应方程式为
Fe+4H++NO3ˉ=Fe3++NO↑+2H2O
Fe+4H++NO3ˉ=Fe3++NO↑+2H2O
. A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:
A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:(1)若A是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶于NaOH溶液,E溶于NaOH溶液的离子方程式是
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
;工业上冶炼A的化学反应方程式是2NaCl(熔融)
2Na+Cl2↑
| ||
2NaCl(熔融)
2Na+Cl2↑
.
| ||
(2)若C是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式是
CaC2+2H2O→C2H2↑+Ca(OH)2
CaC2+2H2O→C2H2↑+Ca(OH)2
;1mol C完全燃烧生成液态水时放热1300kJ,则C完全燃烧的热化学方程式是2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2600kJ?mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2600kJ?mol-1
.A与盐B的溶液反应时只生成气体C、碳酸钙沉淀和水,则B的化学式是Ca(HCO3)2
Ca(HCO3)2
.下表是元素周期表的一部分,、A、B、C、D、E、X、Y是下表中给出元素组成的常见单质或化合物.
I.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
(1)若E为氧化物,则 A与水反应的化学方程式为
①当X是碱性盐溶液,C分子中有22个电子时,则X呈碱性的离子方程式为
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为
(2)若E为单质气体,D为白色沉淀,A的化学式可能是(填两种)
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式
II.元素周期表是人们研究物质性质的重要工具.
(1)As的原子结构示意图
 .其氢化物的化学式
.其氢化物的化学式
(2)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂.As可与Y的水溶液反应,生成As的最高价含氧酸,该反应的化学方程式为
查看习题详情和答案>>
| ① | |||||||||||||||||
| ④ | ⑤ | ⑥ | |||||||||||||||
| ② | ③ | ⑦ | |||||||||||||||
| Fe | As | ||||||||||||||||

(1)若E为氧化物,则 A与水反应的化学方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.①当X是碱性盐溶液,C分子中有22个电子时,则X呈碱性的离子方程式为
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
.②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为
Fe+4H++NO3-═Fe3++NO↑+2H2O
Fe+4H++NO3-═Fe3++NO↑+2H2O
.(2)若E为单质气体,D为白色沉淀,A的化学式可能是(填两种)
Na、Na2O2或NaH
Na、Na2O2或NaH
,B含有的化学键类型为离子键和极性共价键
离子键和极性共价键
,C与X反应的离子方程式为3AlO2-+Al3++6H2O═4Al(OH)3↓
3AlO2-+Al3++6H2O═4Al(OH)3↓
.(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式
CO+H2O?CO2+H2
CO+H2O?CO2+H2
.II.元素周期表是人们研究物质性质的重要工具.
(1)As的原子结构示意图


AsH3
AsH3
.(2)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂.As可与Y的水溶液反应,生成As的最高价含氧酸,该反应的化学方程式为
5NaClO+2As+3H2O═2H3AsO4+5NaCl
5NaClO+2As+3H2O═2H3AsO4+5NaCl
.当消耗1mol还原剂时,电子转移了5
5
mol.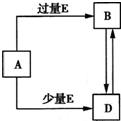 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )